Ein Herz lässt sich reparieren
Bei Mäusen stellt eine Umstellung des Energiestoffwechsels die Herzfunktion nach einem Infarkt wieder her
Nach der Geburt verliert das menschliche Herz seine Regenerationsfähigkeit nahezu vollständig. Eine Schädigung des Herzmuskels zum Beispiel durch einen Herzinfarkt schädigt diesen daher bei Erwachsenen in der Regel dauerhaft. Wissenschaftler vom Max-Planck-Institut für Herz- und Lungenforschung zeigen nun erstmals an Mäusen, dass eine Veränderung des Energiestoffwechsels von Herzmuskelzellen eine Regeneration des Herzens ermöglicht. Die Forschenden konnten so die Herzfunktion der Tiere nach einem Herzinfarkt weitestgehend wiederherstellen. Die Studie ist bahnbrechend und könnte völlig neue therapeutische Ansätze ermöglichen.

Kurz nach der Geburt verliert das menschliche Herz weitestgehend seine Fähigkeit, sich im Falle von Schädigungen selbst zu reparieren. Bei Verletzungen oder Erkrankungen des Herzmuskels kommt es daher zu dauerhaften Schäden und zu einer Einschränkung der Herzfunktion. Der Herzmuskel verliert seine Regenerationsfähigkeit unter anderem deshalb, weil sich die Herzmuskelzellen nach der Geburt nicht mehr teilen können. Dies geht einher mit einer fundamentalen Umstellung des Energiestoffwechsels der Herzzellen: Statt der als Glykolyse bezeichneten Energiegewinnung aus Zuckern beziehen die Herzmuskelzellen ihre Energie nun weitestgehend aus Fetten. Diese Form der Energiegewinnung bezeichnet man als Fettsäureoxidation.
Die Arbeitsgruppe von Thomas Braun, Direktor am Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim, hat auf der Suche nach neuen Verfahren, die Regeneration von Herzen zu befördern, bei der Energiegewinnung angesetzt: „Man weiß, dass Tierarten, die ihr Herz regenerieren können, als Brennstoff für Herzmuskelzellen vor allem Zucker und Glykolyse nutzen. Auch das menschliche Herz nutzt in frühen Entwicklungsstadien vor allem Glykolyse, schaltet dann aber auf Fettsäureoxidation um, da hierdurch mehr Energie gewonnen werden kann“, erklären Xiang Li und Xuejun Yuan, Autoren der Studie. „Mit dem Wechsel der Energiegewinnung nach der Geburt ändert sich die Aktivität vieler Gene und die Zellteilungsaktivität geht verloren. Einzelne Stoffwechselprodukte aus der Energiegewinnung haben auch wichtige Funktionen für die Aktivität von Enzymen, welche Genaktivitäten regulieren. Wir erhofften uns daher, durch die Umprogrammierung des Energiestoffwechsels Veränderungen in Genaktivitäten auszulösen, um die Zellteilungsfähigkeit bei Herzmuskelzellen wieder einzuschalten.“
Inaktiviertes Gen für Fettsäureoxidation

Hierzu inaktivierten die Max-Planck-Forscher in Mäusen zunächst ein Gen namens Cpt1b, das für die Fettsäureoxidation wesentlich ist. „Wir beobachteten daraufhin, dass in diesen Mäusen die Herzen wieder anfingen zu wachsen“, erklärt Li. Im Verlauf des Experiments verdoppelten sich die Zellzahlen in den Herzen dieser Mäuse nahezu.
Im nächsten Schritt lösten die Bad Nauheimer Forscher Herinfarkte in Mäusen aus, in denen Cpt1b ausgeschaltet war. Bei dem gewählten Ansatz folgt einer Phase fehlender Durchblutung des Herzens eine Reperfusionsphase, bei der das Herz wieder mit sauerstoffreichem Blut durchspült wird. „Dieses Modell ist vergleichbar mit einem Herzpatienten, dessen Herz aufgrund eines Verschlusses der Herzkranzgefäße mit dem Einsetzen eines Stents behandelt wird“, erklärt Yuan. Der Effekt war beeindruckend: Sonst übliche Narben im Herzmuskel waren nach Wochen kaum mehr zu beobachten und die Kontraktionsfähigkeit bei Tieren ohne Cpt1b erreichte fast wieder das Niveau vor dem Infarkt.
Regenerationsfähigkeit kehrt zurück
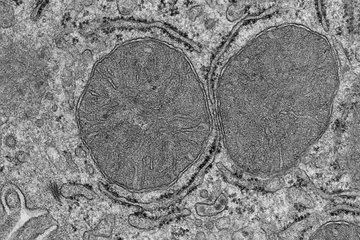
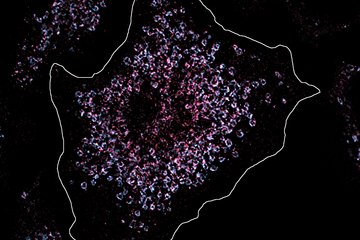
Schlagendes Mäuseherz nach einem Infarkt
In weiteren Untersuchungen konnten die Wissenschaftler den zugrundeliegenden Mechanismus entschlüsseln: „In Herzmuskelzellen der Mäuse mit dem inaktivierten Gen fanden wir einen zwanzigfach erhöhten Spiegel von alpha-Ketoglutarat. Der hohe Spiegel dieses Stoffwechselproduktes führt zu einer deutlichen Erhöhung der Aktivität des Enzyms KDM5“, erläutert Braun. Bei diesem Enzym handelt es sich um eine sogenannte Histon-Demethylase, welche Methylgruppen von Histonen entfernt und so die Aktivität verschiedener Gene reduziert. Durch die Änderung der Genaktivität werden Herzmuskelzellen unreifer und erlangen so die Regenerationsfähigkeit zurück.
Braun sieht in der Studie einen echten Durchbruch: „Mit der Umprogrammierung des Stoffwechsels verdoppeln wir die Anzahl der Herzmuskelzellen und nach einem Infarkt wird die Herzfunktion fast komplett wiederhergestellt.“ Zudem ist es prinzipiell möglich, die Aktivität das Enzym CPT1B -das Genprodukt von Cpt1b- pharmakologisch zu blockieren. Die Entwicklung eines Hemmstoffs, mit dem die Aktivität des Enzyms CPT1B beeinflusst werden kann, ist der nächste Schritt auf dem Weg zur Entwicklung einer Therapie, die eventuell auch beim Menschen eingesetzt werden kann. Yuan und Braun betonen jedoch: „Wir haben noch einen langen Weg vor uns, bis verlässliche Behandlungen am Menschen möglich werden. Die Umsetzung von neuen Erkenntnissen aus der Grundlagenforschung ist langwierig und teuer und geht häufig mit vielen unerwarteten Problemen einher. Dennoch sind wir zuversichtlich, die Regenerationsfähigkeit des Herzens in der Zukunft therapeutisch stimulieren zu können.“