Giftspritze mit Gummiband
Tc-Toxine injizieren bakterielle Giftstoffe auf bislang unbekannte Weise
Bakterien haben viele verschiedene Wege entwickelt, um ihre giftige Ladung in Zellen einzuschleusen. Die dreiteiligen Tc-Giftkomplexe, die unter anderem vom Pesterreger Yersinia pestis oder dem Insektenkrankheitserreger Photorhabdus luminescens verwendet werden, sind besonders ungewöhnlich. Stefan Raunser vom Max-Planck-Institut für molekulare Physiologie in Dortmund und seine Kollegen von der Universität Freiburg haben Aufnahmen dieser „Giftspritzen“ mit sehr hoher Detailgenauigkeit angefertigt. Darauf sieht man, woher die Molekülkomplexe die Energie zum Durchstoßen der Zellmembran nehmen. Diese Proteine könnten Anwendung in der Medizin finden und zum Beispiel Medikamente gezielt in Krebszellen transportieren.
Photorhabdus luminescens lebt in Symbiose mit räuberischen Fadenwürmern. Das Bakterium wartet in den Eingeweiden der Würmer darauf, dass der Fadenwurm ein Insekt angreift. Dann erst schlägt die große Stunde des Bakteriums. Es setzt Tc-Giftkomplexe frei, die das Insekt binnen kurzer Zeit töten. Am Kadaver laben sich dann sowohl der Fadenwurm als auch die Bakterien, bevor sie zu ihrem nächsten Opfer weiterziehen.
„Bisher wussten wir nicht viel von der Struktur der Tc-Komplexe“, sagt Stefan Raunser. „Wir hatten nur ein grobes Bild, jetzt besitzen wir Bilder, mit denen wir sogar einzelne Atome unterscheiden können!“ Mit Hilfe von Röntgenkristallografie und Kryoelektronenmikroskopie sind den Forschern detaillierte Aufnahmen gelungen. „Es gibt wahrscheinlich keine andere Struktur eines Proteinkanals, in dem man sogar das Protein im Kanal sehen kann“, so Stefan Raunser.
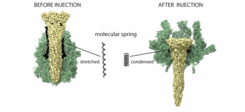
Die Tc-Komplexe bestehen aus den drei Untereinheiten TcA, TcB und TcC. TcA formt den Kanal, der wie eine Spritze die Zellmembran durchdringt und das giftige Enzym in die Zelle transportiert. Doch woher die Energie dafür kommt, war bisher unbekannt.
„TcA besitzt eine aus 48 Aminosäuren bestehende Proteinkette, die gedehnt ist wie ein Gummiband oder eine Feder“, so Raunser. Zieht sich das Band beziehungsweise die Feder zusammen, wird Energie frei, die den Kanal durch die Membran stößt. Dieser Mechanismus unterscheidet die Tc-Komplexe von allen anderen bekannten porenformenden Injektionsproteinen, wie sie bei Diphtherie- oder Anthrax-Bakterien vorkommen.
Die TcA-Untereinheit ist außerdem für die Bindung des Komplexes an die Wirtszelle verantwortlich. Dafür stehen ihr gleich 20 Rezeptor-Bindedomänen zur Verfügung. „Wir vermuten, dass immer vier davon einen Rezeptor umschließen und somit die Stärke der Bindung erhöhen“, erklärt Raunser.
Diese Rezeptor-Bindedomänen lassen sich leicht entfernen oder gegen andere Domänen austauschen. „Dadurch könnte man die Tc-Komplexe zu ganz bestimmten Zellen dirigieren, zu Krebszellen beispielsweise oder auch zu anderen Körperzellen.“ Dort angelangt könnten die Tc-Komplexe therapeutisch wirksame Moleküle in die Zellen spritzen. Auch in der Landwirtschaft könnten die insektenpathogenen Tc-Komplexe als Pflanzenschutzmittel zum Einsatz kommen.
CS/HR











