Diagnostik mit der Magenpille
Für eine Magenspiegelung müssen Patienten heute meist noch den Schlauch eines Endoskops schlucken. Denn Kapseln mit Kameras, die dafür auch geeignet sind, lassen sich bislang nicht steuern. Das wollen Wissenschaftler um Metin Sitti, Direktor am Max-Planck-Institut für Intelligente Systeme in Stuttgart, ändern. Und ihre kleinen, kapselförmigen Roboter schießen nicht nur Bilder des Mageninneren.
Text: Tim Schröder

Eine Magenspiegelung ist eine unangenehme Prozedur. Wer schon einmal wegen lang anhaltender Bauchschmerzen oder anderer Beschwerden beim Arzt war und eine Gastroskopie über sich ergehen lassen musste, der weiß, wie eigenartig es sich anfühlt, einen langen Schlauch zu schlucken. Gastroskop nennt man diese Röhre, in der ein Lichtleiter sitzt, der das Kamerabild von der Schlauchspitze nach draußen zu einem Monitor überträgt. Die Gastroskopie ist heute Standard. Ärzte nutzen sie, um im Magen oder im Zwölffingerdarm nach Entzündungen oder Tumoren zu suchen. Für den Patienten ist das stets eine Belastung.
Seit gut zehn Jahren greifen Ärzte in Einzelfällen daher auf eine kleine Hightech-Alternative zurück – Kapselendoskope: Minikameras von der Größe eines Lutschbonbons. Patienten müssen dann nur noch die Kapsel schlucken, schon beginnt die Reise durch Magen und Darm. Während die Kapsel durch den Verdauungstrakt wandert, schießt sie Hunderte von Bildern, die sie per Funk zu einem Speicher sendet, den der Patient für einige Stunden am Gürtel trägt.
Ärzte setzen die Kapselendoskope ein, wenn im Stuhl des Patienten Blut auftritt und sich die Wunde weder mit einer Magen- noch mit einer Darmspiegelung entdecken lässt. In solchen Fällen liegt die Blutung oftmals im Dünndarm, der von außen nicht erreichbar ist. Für die Untersuchung im engen Dünndarm ist die Kapselendoskopie bestens geeignet. Im vergleichsweise großen Magen oder im Dickdarm aber hängt es auch vom Zufall ab, ob das erkrankte Gewebe tatsächlich ins Blickfeld der Kamera gelangt. Zudem sind die Bilder von dort oftmals unscharf, weil sich der Abstand der Kapsel zur Wand des Organs ständig ändert und diese sich nur zufällig im Fokus befindet. Denn die Kapseln lassen sich von außen nicht steuern wie die Kamera an der Spitze des klassischen Endoskops.
Bereits seit einiger Zeit arbeiten Wissenschaftler deshalb an Kapseln, die Patienten wie Pillen schlucken. Solche Kapseln sollen sich steuern lassen und eignen sich somit auch für die Untersuchung von Magen und Dickdarm. So endete bereits vor vier Jahren ein EU-Projekt, in dem Experten von mehreren Firmen und wissenschaftlichen Einrichtungen eine Roboterkapsel entwickelt hatten, die sich wie ein Insekt mit kleinen Beinchen durch Darm und Magen bewegte. Allerdings verbrauchte das Krabbeln so viel Strom, dass der Energievorrat des Roboters viel zu schnell zur Neige ging.
Andere Forscherteams bevorzugen daher Roboterkapseln, die magnetische Partikel oder Teile enthalten und sich von außen über Magnetfelder steuern lassen. Bewegt man das Magnetfeld ein Stückchen, folgt die runde Kapsel und kullert im Magen langsam voran. Wie Versuche im Labor zeigen, funktioniert diese Fortbewegung recht gut.
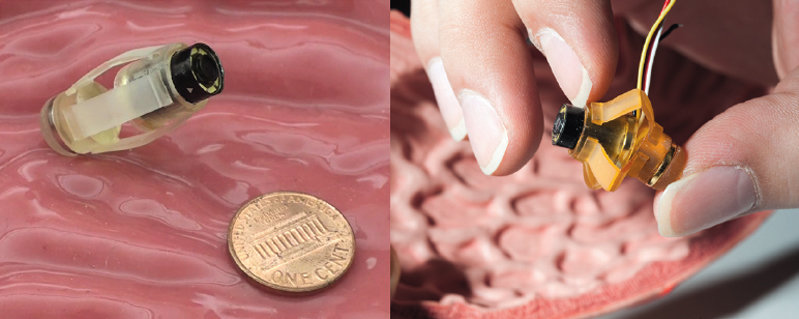
Auch Metin Sitti entwickelt Kapselroboter, die sich über Magnetfelder von außen bewegen lassen. Millibots nennt er die nur einige Millimeter großen Apparate, die zunächst vor allem für die Untersuchung des Magens optimiert werden. Der Doktorand Son Donghoon und andere Mitarbeiter Sittis haben die Roboter von der Form einer Medikamentenkapsel schon etliche Stunden durch künstliche Mägen aus Silikon oder durch echte Schweinemägen wandern lassen.
Fähigkeiten, die in Bauweise oder Material stecken
Die Steuerung solcher Maschinen zum Laufen zu bringen ist ein Spezialgebiet von Metin Sitti. Er hat schon langbeinige Roboter entwickelt, die wie Wasserläufer über Pfützen hinweggleiten, und Flugapparate, die wie Schmetterlinge flattern. Lange Zeit lehrte er als Professor für Maschinenbau an der Carnegie Mellon University in Pittsburgh. Seit einem Jahr leitet er das neue Department für Physische Intelligenz am Max-Planck-Institut für Intelligente Systeme in Stuttgart.
Physische Intelligenz – der Begriff klingt erst einmal nach einem Widerspruch, weil der Geist eines Roboters eher in seiner Software vermutet wird. „Physische Intelligenz bedeutet, dass die Intelligenz beziehungsweise die Fähigkeiten einer Maschine nicht allein in der Steuerung, sondern vor allem auch in ihrer Bauweise oder dem Material stecken“, erklärt Metin Sitti; etwa so wie beim Wasserläufer, der sein Gewicht über die langen Beine so verteilt, dass er nicht untergeht, sondern auf dem Wasser schwebt und die Oberflächenspannung nutzt, um sich fortzubewegen.
Sitti und seine Mitarbeiter sind ausgesprochen kreativ darin, neue Materialien zu finden, mit denen sie die Roboter besser für ihre jeweiligen Einsatzgebiete ausstaffieren können, als es mit den klassischen Apparaten aus Stahl, Plastik und Elektronik möglich wäre. Ein aktuelles Beispiel sind die Millibot-Kapseln. Anders als herkömmliche Kapselendoskope haben sie keine harte Hülle. Stattdessen wird das 24 Millimeter lange Konstrukt von Streifen aus weichem Polyurethan-Kunststoff zusammengehalten, einem Material, das in ähnlicher Form auch zu Sohlen von Laufschuhen verarbeitet wird. Zudem befinden sich kleine Magneten oben und unten in den Kapseln, die eiförmig sind – etwa wie ein Rugbyball.
Die biegsame Hülle verleiht der kleinen Gummikapsel die einzigartige Fähigkeit, sich zusammenziehen zu können. Denn jeder Polyurethanstreifen wird der Breite nach von einer Falz durchzogen. So kann ein äußeres Magnetfeld die Streifen zusammenfalten; die Kapsel wird plattgedrückt. Zu diesem Zweck zieht ein äußeres Magnetfeld die Kapsel zunächst aufrecht an die Magenwand. Erhöhen die Forscher das Magnetfeld nun, zieht es die Magneten im Kapselinneren zusammen.
Sobald das Magnetfeld schwächer wird, schnellen die Polyurethanstreifen in ihre ursprüngliche Gestalt zurück, da das Material elastisch ist. Der Millibot nimmt wieder seine Kapselform an. Sitti hat das Maschinchen Masce getauft: „Magnetically Actuated Soft Capsule Endoscope“ – „magnetisch angetriebenes Endoskop mit weicher Kapsel“.
Ein Roboter, der sich quetschen lässt wie ein Gummiball, mutet nicht gerade nach Hightech an. Doch der deformierbare Millibot hat es in sich. Für gewöhnlich können Kapselendoskope nur seitlich rollen oder sich überschlagen und Fotos schießen. Mit dem Zusammenpressen jedoch beherrschen sie jetzt eine ganz andere Bewegung, die dem Endoskop völlig neue Fähigkeiten verleiht.
Metin Sitti und seine Mitarbeiter haben etwa einen kleinen Tank entwickelt, der sich öffnet, wenn Masce im Magnetfeld zusammengepresst wird – und wieder schließt, wenn das Magnetfeld nachlässt. Im Labor haben die Forscher damit, Spritzer für Spritzer, kleine Mengen von Tinte freigesetzt.
Masce setzt gezielt kleine Wirkstoffmengen frei
„Wir stellen uns vor, dass Ärzte damit künftig im Magen oder im Darm gezielt geringe Mengen an Medikamenten dosieren – etwa bei Entzündungen oder einzelnen Tumoren“, sagt Sitti. Viele Menschen und insbesondere ältere Patienten vertragen Medikamente nicht, wenn sie diese schlucken. „Mit Masce könnten wir sehr viel gezielter kleine Wirkstoffmengen direkt an Ort und Stelle freisetzen“, so Sitti. Die Belastung für den Patienten wäre geringer. Es ist sogar denkbar, dass Masce mehrere Tage lang im Magen verweilt, um eine Entzündung oder einen Tumor über längere Zeit zu behandeln.

Normalerweise gleiten Objekte nach kurzer Zeit durch den Ausgang des Magens, den Pförtner, in den Zwölffingerdarm. Auch bei der Masce-Kapsel wäre das der Fall. Um Wirkstoffe gegen eine Entzündung oder einen Tumor über längere Zeit freizusetzen, haben Die Forscher um Metin Sitti daher einen zweiten Typ der Kapsel entwickelt. Diese lässt sich durch ein äußeres Magnetfeld zu einer dicken Scheibe zusammendrücken und behält diese Form dann auch, wenn das Magnetfeld abgeschaltet wird. So kann sie für mehrere Tage im Magen verweilen. Diese Variante von Masce enthält nämlich zwei Magneten – an beiden Enden ihrer Längsachse je einen –, deren Kraft jedoch normalerweise nicht ausreicht, die Kapsel zusammenzuquetschen. Erst ein Magnet von außen bringt die Magneten so weit zusammen, dass sie sich auch allein stark genug anziehen.
Sobald die Behandlung beendet ist, kann wiederum ein äußeres Magnetfeld die Anziehungskraft zwischen den Kapselmagneten schwächen. Die Kapsel schnellt in die ursprüngliche Form zurück und kann den Pförtner passieren.
Zusammen mit der Arbeitsgruppe um den Materialforscher David Gracias von der Johns Hopkins University in Baltimore hat Sitti noch eine weitere wichtige Funktion in den Masce-Millibot eingebaut – die Fähigkeit, Biopsien durchzuführen. So nehmen Ärzte für gewöhnlich während einer Magenspiegelung Proben der Schleimhaut, um verdächtiges Gewebe im Labor auf Entzündungen oder Tumoren zu untersuchen. Dazu schiebt der Arzt eine Art Draht mit einer kleinen Zange in das Gastroskop hinein.
Mikrogreifer verbeißen sich im Gewebe
Kapselendoskope können bislang keine Gewebeproben nehmen, der Masce-Millibot hingegen schon. Zusammen mit David Gracias kam Metin Sitti auf die Idee, Masce mit winzigen, wenige Mikrometer breiten Greifern zu füllen. Diese Mikrogreifer, Microgripper genannt, ähneln kleinen Sternen, deren Zacken sich wie Krallenhände zusammenziehen und im umgebenden Gewebe verbeißen, wenn sie sich auf Körpertemperatur erwärmen. Denn die Zacken bestehen aus einer Metall- und einer Polymerschicht, die sich bei steigender Temperatur unterschiedlich stark ausdehnen, sodass sich die Zacken biegen.
Die Kunst besteht nun darin, die kleinen Greifer an der richtigen Stelle auszulösen, beispielsweise erst im Magen. Im Biopsie-Experiment klappte das. Metin Sitti füllte die kleine Kammer des Masce mit Microgrippern und positionierte sie mithilfe des Magnetfelds auf einem Stück Schweinemagen. Als die Kapsel im Magnetfeld zusammengedrückt wurde, rieselten die Greifer auf das Gewebe hinab. Und nachdem die Forscher die Temperatur erhöht hatten, schnappten die Greifer zu.
„Eine Zeit lang hatten wir uns gefragt, wie wir die Microgripper wieder einsammeln könnten – und kamen schließlich auf die Idee, das eine Ende der Masce-Kapsel mit einer bürstenähnlichen Struktur aus Silikon zu beschichten, in der die Microgripper hängen bleiben sollten“, erzählt Sitti. Auch das klappte im Experiment. Die Forscher richteten Masce im Magnetfeld senkrecht auf und drückten das Kapselendoskop samt den Silikonbürstchen fest aufs Gewebe. Tatsächlich blieben einige Greifer im Silikon haften und ließen sich mit Masce abtransportieren. Natürlich, räumt Sitti ein, greife ein Gripper nur eine kleine Menge Gewebe. Für eine Laboranalyse aber dürfte das ausreichen, meint er.
Metin Sitti kann sich außerdem vorstellen, die Mikrogreifer künftig auch im Dickdarm einzusetzen. Da die Greifwerkzeuge bis dorthin aber bereits mehrere Stunden durch den Körper gewandert wären, schnappten sie schon zu, ehe sie den Dickdarm erreicht hätten. Allerdings ließen sie sich mithilfe eines äußeren Magnetfeldes erwärmen, sagt Sitti – etwa so, wie man einen Kochtopf auf einem Induktionsherd erhitzt.
Noch ist Masce nicht reif für den Einsatz am Patienten. Doch Metin Sitti hat bereits gezeigt, dass die intelligenten Kapselendoskope aus Polyurethan mehr können als ihre heute gebräuchlichen Vorläufer, die lediglich fotografieren. Allerdings sind noch einige Herausforderungen zu meistern.
Voraussetzung für den späteren Einsatz im Patienten ist etwa, Masce millimetergenau positionieren zu können. Dazu müssen nicht nur das Magnetfeld und mit ihm die Kapsel hochpräzise gesteuert werden. Der künftige Anwender muss auch im Kamerabild genau erkennen können, welchen Teil des Magens er eigentlich gerade betrachtet. Ein Arzt, der heute ein herkömmliches Gastroskop benutzt, kann die Kamera am Ende des langen Schlauches gezielt hin- und herdrehen.
Woher aber soll man künftig wissen, wohin eine Kapsel blickt, die gerade durch den Magen kullert? „Letztlich wollen wir ein System entwickeln, mit dem ein Arzt wie mit dem klassischen Gastroskop in Echtzeit und live den Magen oder andere Bereiche des Verdauungstraktes betrachten kann“, sagt Mehmet Turan, der sich als Doktorand in Sittis Department mit der Bildanalyse von Masce beschäftigt.
Dafür reicht die Bildqualität bislang allerdings noch nicht: Die kleine Masce-Kamera hat eine Auflösung von gerade einmal 250 mal 250 Pixeln, die zum Teil verschwommene Bilder liefert. Hinzu kommen die Reflexionen der feucht glänzenden Schleimhaut, die den Blick auf das Gewebe stören, und die peristaltischen Bewegungen des Magens.
Mehmet Turans Aufgabe ist es, Masce die optischen Schwächen auszutreiben. Turan hat Elektro- und Informationstechnik studiert und ist Spezialist für Computer Vision – das maschinelle Sehen. Er beschäftigt sich mit der Frage, wie Roboter die Umgebung wahrnehmen und analysieren können – und vor allem auch, wie sich mithilfe des Computers selbst schlechte Bilder nutzen lassen. „Ich versuche, das Problem zu lösen, indem ich den Computer viele einzelne Bilder, sogenannte Frames, analysieren und miteinander verschmelzen lasse, auf diese Weise lassen sich Schwächen in einem Bild mithilfe anderer Aufnahmen ausgleichen.“
Eine genaue 3-D-Landkarte des Mageninneren
Mehmet Turans großes Ziel ist es, mit dem Masce-System künftig für jeden Patienten eine genaue 3-D-Landkarte des Mageninneren zu erzeugen, sodass sich ein Arzt mithilfe von Masce zukünftig sicher orientieren kann. Diese Karte soll Strukturen zeigen, die feiner als ein Millimeter sind. Auch Tumoren oder Entzündungen sollen darin genau zu sehen sein. „Wenn wir irgendwann einmal mit einem Kapselendoskop gezielt Tumoren mit Medikamenten behandeln wollen, dann muss der Arzt genau wissen, wo sich das kranke Gewebe befindet – das geht nur, wenn wir die Magnetfeldsteuerung mit dem Bild, das Masce liefert, koordinieren“, sagt Turan.
Schwierig ist die Arbeit des Forschers nicht zuletzt, weil die Schleimhaut des Magens überall gleich aussieht. „Wenn eine Maschine eine Landschaft betrachtet, dann gibt es klare Objekte oder Strukturen, an denen sie sich orientieren kann – im Magen fehlen diese.“ Turan versucht daher, aus den verschiedenen Frames bestimmte Merkmale, sogenannte Landmarken, zu extrahieren, die dem Computer Orientierungshilfe geben. Experten sprechen dabei auch von klar unterscheidbaren Charakteristika, den distinguishable features, oder auch corners, den Ecken. Im Magen könnten das besonders auffällige Falten in der Schleimhaut oder Blutgefäße sein.
Der Vorteil solcher Landmarken besteht auch darin, dass sich der Computer schneller zurechtfindet. Das ist wichtig, wenn die Bilder später in Echtzeit analysiert und wiedergegeben werden sollen. Eine Herausforderung liegt dabei vor allem im Abschätzen der Tiefe. Bekanntlich haben Tiere zwei Augen, weil im Stereobild besser zu erkennen ist, wie weit Objekte entfernt sind – denn beide Augen blicken aus einer etwas anderen Perspektive in die Ferne.
Die Kamera, die derzeit in Masce verbaut ist, hat aber nur eine Linse. Entsprechend schwer lässt sich auf ihren Bildern abschätzen, wie tief die Strukturen in der Magenschleimhaut sind – beispielsweise Falten. Auch dieses Problem will Turan in den kommenden Monaten mit dem Maschinenlernen lösen. Der Computer wird sich bei der Analyse der Frames wiederum an den Landmarken im Organ orientieren, zum Beispiel an Falten oder anderen Erhebungen. Er wird mehrere Frames miteinander vergleichen, die aus verschiedenen Blickwinkeln aufgenommen worden sind, und daraus die dreidimensionale Gestalt der Oberfläche berechnen.
Das wird künftig wichtig sein, um Mikrogreifer oder Medikamente auf den Millimeter genau freisetzen zu können. Während die Kapsel wandert, wird die Position der Landmarken verfolgt, sodass der Computer feststellen kann, wie weit sich die Kapsel relativ zur Landmarke bewegt hat.
Um die 3-D-Gestalt des Mageninneren besser erkennen zu können, wird Turan auch die Methode der Streifenprojektion anwenden. Bei diesem Verfahren, das auch als structured lighting bezeichnet wird, wirft ein Projektor ein Muster aus gleichförmigen parallelen Streifen auf einen Gegenstand. Wegen dessen dreidimensionaler Gestalt werden die Lichtstreifen auf ihm verzerrt. Nimmt man das verzerrte Muster mit einer Kamera aus verschiedenen Winkeln auf, lässt sich daraus die 3-D-Struktur berechnen.
Dank maschinellen Lernens krankes Gewebe erkennen
Mehmet Turan weiß, dass es eine Herausforderung ist, ein solches Streifenmuster mit dem nur wenige Millimeter kleinen Masce auf die Magenschleimhaut zu projizieren. Zum einen benötigt er dafür eine Streifenmaske, die genaue Lichtstreifen von weniger als einem Millimeter Breite erzeugt. Diese hat der Kamerahersteller eigens für die Stuttgarter Arbeitsgruppe angefertigt. Ob sie funktioniert, muss sich noch zeigen, denn das Streifenmuster muss für die Messung gestochen scharf auf die Magenwand geworfen werden. „Dafür benötigen wir außerdem stark fokussiertes Licht – das wiederum braucht viel Strom und eine entsprechend starke Bordbatterie“, sagt Turan. Doch er ist zuversichtlich, dass die Streifenprojektion gelingen kann.

Essenziell für die behandelnden Ärzte wird es künftig sein, gesundes von krankem Gewebe zu unterscheiden, um Masce präzise auf dem Tumor oder einem Entzündungsherd positionieren zu können. Auch dabei soll der Computer Hilfestellung geben. Damit dieser krankes Gewebe erkennt, setzt Turan ebenfalls Methoden des maschinellen Lernens ein und wird den Computer mit Bildern von gesundem und krankem Gewebe anlernen.
„Noch wissen wir allerdings nicht, anhand welcher Bildmerkmale oder Features in den Masce-Bildern der Computer die Gewebetypen am besten unterscheiden könnte – auch das gehört zum Lernprozess“, sagt Turan. Er gibt ein Beispiel: Will man einem Computer beibringen, zwischen Mann und Frau zu unterscheiden, muss der zunächst lernen, dass das Feature „Hat zwei Augen“ nicht geeignet ist, um das Geschlecht zu erkennen.
Turan meint, dass sich für die Differenzierung zwischen krankem und gesundem Gewebe bestimmte Farbmerkmale, etwa die Sättigung, Helligkeit oder der Farbton der Schleimhaut, eignen könnten. „Letztlich füttern wir unsere Algorithmen mit einer Fülle von Parametern“, sagt er. „Aufgabe des Computers ist es dann, jene Features zu finden, die die stärksten Hinweise darauf geben, ob das Gewebe gesund oder krank ist.“
Was die medizinischen Anwendungen in der Arbeit Metin Sittis angeht, ist das Masce-System derzeit am weitesten entwickelt. Als Robotikspezialist verfolgt er aber noch andere Ansätze. Einer besteht darin, die Roboter noch kleiner zu machen als den Millibot Masce und auf Mikrometerdimension zu schrumpfen. „Die Vision ist, Systeme zu entwickeln, die so klein sind, dass sie nicht nur im Darm und Magen, sondern sogar im Körperinneren arbeiten können.“
So winzige Roboter haben ein fundamentales Problem. Je kleiner sie sind, desto weniger Energie kann man in ihnen speichern, um sie anzutreiben. Schrumpft man Batterien auf Mikrometerdimension, sind schnell Grenzen erreicht. Wie bei Masce setzt Sitti daher auf Antriebe, die ohne Strom auskommen. Auch hier experimentieren Sittis Mitarbeiter mit Magnetfeldern.
Eine ganz andere Idee verfolgen die Forscher mit Mikrorobotern, die von Bakterien angetrieben werden. So ist es dem Team um Sitti gelungen, Bakterien, die sich mit kleinen Peitschenschwänzen, den Flagellen, fortbewegen, auf die Oberfläche winziger Kugeln zu heften. Locken die Wissenschaftler die Bakterien mit Nährstoffen, beginnen diese auf die Nahrungsquelle zuzuschwimmen und die Kugel mit sich zu ziehen.
Es ist vorstellbar, dass sich auf diese Weise Medikamente künftig gezielt durch den Körper transportieren lassen – etwa mit Bakterien, die auf die chemischen Signale von Tumorgewebe reagieren. „Solche Ansätze sind hochinteressant, weil wir damit die Beschränkungen der herkömmlichen Robotik überwinden“, sagt Metin Sitti. „Aber natürlich ist all das noch Zukunftsmusik.“
Da ist Masce für ihn schon ein gutes Stück weiter: „Eine solche Magenkapsel – die könnte ich mir schon in wenigen Jahren in der klinischen Anwendung vorstellen.“
AUF DEN PUNKT GEBRACHT
-
Eine Magenspiegelung belastet Patienten, weil sie meist den Schlauch eines Endoskops schlucken müssen. Heutige kapselförmige Endoskope lassen sich noch nicht steuern und liefern daher nur zufällig scharfe Bilder von Krankheitsherden.
-
Forscher des Max-Planck-Instituts für Intelligente Systeme in Stuttgart entwickeln daher einen kapselförmigen Roboter (Magnetically Actuated Soft Capsule Endoscope, kurz Masce), der sich mit einem Magnetfeld von außen kontrollieren lässt.
-
Die Millibots lassen sich so konstruieren, dass sie an einer Entzündung oder einem Tumor auch über einen längeren Zeitraum gezielt medizinische Wirkstoffe abgeben. In einer anderen Variante können sie winzige Greifer freisetzen, die Gewebeproben nehmen.