Mülldeponien in Nervenzellen
Proteinablagerungen im Gehirn gelten schon lange Zeit als schädlich und als Auslöser für Alterskrankheiten wie Alzheimer, Parkinson und Chorea Huntington. Unter welchen Bedingungen diese als Aggregate bezeichneten Ablagerungen auch Altersprozesse verlangsamen können, erklärt Franz-Ulrich Hartl, Direktor am Max-Planck-Institut für Biochemie in Martinsried.

Hat Sie die Erkenntnis erstaunt, dass Proteinablagerungen in Zellen auch nützlich sein können?
Franz-Ulrich Hartl: Ja sehr, obwohl es in der Literatur bereits Hinweise gab, dass diese nicht generell schädlich sind. Es kommt darauf an, um welche Aggregate es sich handelt, welche Formen und Eigenschaften diese haben.
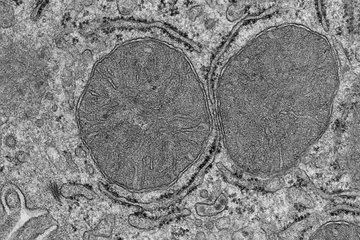
Wissenschaftler haben ursprünglich angenommen, dass neurodegenerative Erkrankungen wie Alzheimer, Parkinson und Chorea Huntington durch große, unlösliche Proteinaggregate, die man als Ablagerungen in den Zellen erkennt, ausgelöst werden. Bei der Untersuchung der Gehirne von Menschen, die im hohen Alter verstorben waren, zeigten sich jedoch relativ häufig erhebliche Proteinablagerungen, obwohl keine Demenz-Symptome vorlagen.
Welche Proteinablagerungen sind schädlich?
In den letzten fünf Jahren ist immer klarer geworden, dass große Ablagerungen im Gehirn nicht grundsätzlich toxisch sind, sondern viel eher die kleineren Formen, sogenannte Oligomere.
Wenn es den Zellen nicht gelingt, die Bildung von Proteinaggregaten von vornherein zu verhindern - und das scheint im Alter tatsächlich der Fall zu sein -, dann greift offenbar ein anderer Mechanismus: Die kleinen Formen werden in größere, unlösliche Aggregate zusammengefasst und an bestimmten Stellen in der Zelle gelagert. Dies ist vergleichbar mit einer Mülldeponie. Auf diese Weise wird das Material, das sonst überall herum liegen würde, gesammelt und teilweise unschädlich gemacht.
Um diesen Prozess besser zu verstehen, haben Sie Fadenwürmer untersucht, kurz- und langlebige Tiere. Was hat dieser Vergleich ergeben?
Der Fadenwurm Caenorhabditis elegans eignet sich sehr gut als Modellorganismus für den Alternsprozess. Sein Organismus besteht bereits aus vielen Zellen und weist klare Organstrukturen auf, wie ein Nerven-, Muskel- und Darmsystem. Die hermaphroditen Tiere altern sehr schnell nach der Eiablage. Da sie kurzlebig sind, können Wissenschaftler sie über viele Generationen hinweg verfolgen. Darüber hinaus kann man mit ihnen leicht genetisch experimentieren.
Wir haben bei kurz- und langlebigen Tieren mehr als 5000 Proteine erfasst und dies zu mehreren Zeitpunkten während der Alterung. Dabei zeigte sich, dass die langlebigen Tiere – sie lebten durchschnittlich etwa 30 Tage -, erhebliche Mengen von Proteinaggregaten in unlöslicher Form ansammelten. Bei den Kontrollwürmern fanden sich dagegen weniger Aggregate.
War die Zusammensetzung der Proteinablagerungen unterschiedlich?
Ja. Die Proteinaggregate der langlebigen Tiere waren besonders reich an Chaperonen. Sie helfen Zellen normalerweise dabei, Proteine richtig zu falten, so dass diese nicht verklumpen können. Darüber hinaus tragen sie dazu bei, dass fehlgefaltete Eiweiße von den Zellen abgebaut werden können.
Wir gehen nun davon aus, dass die Chaperone zusätzlich die bereits entstandenen Mülldeponien „versiegeln“, indem sie an die aktive Oberfläche der Proteinaggregate binden. Wenn dies der Fall ist, das müssen wir jedoch noch testen, dann könnten die toxischen Prozesse, die sich an der Oberfläche großer Proteinablagerungen abspielen, zumindest minimiert werden.
Welcher Mechanismus verbirgt sich dahinter?
Das ist noch nicht genau klar. Wahrscheinlich ist jedoch, dass eine besondere Klasse von Chaperonen dabei eine Rolle spielt, das sind die sogenannten kleinen Hitzeschockproteine (sHsp). Dieser Name ist jedoch irreführend. Denn tatsächlich bilden diese Proteine in Wirklichkeit größere Strukturen, die in der Lage sind, gleichzeitig mehrere fehlgefaltete Proteinmoleküle zu binden.
Bislang gingen Forscher immer davon aus, dass die Funktion dieser kleinen Hitzeschockproteine darin besteht, die Aggregation zu verhindern. Allerdings gab es in der Literatur auch schon Hinweise darauf, dass sie unter bestimmten Bedingungen die Aggregation auch antreiben und sogar fördern können.
Da wir in den Aggregaten der langlebigen Würmer andere kleine Hitzeschockproteine gefunden haben als in den kurzlebigen, gehen wir davon aus, dass die Eigenschaften und Spezifität dieser Hitzeschockproteine etwas mit diesem Phänomen zu tun haben könnte.
Wie wollen Sie diesen Mechanismus klären?
Unter anderem mit einen biochemischen Ansatz. Wir wollen in einem nächsten Schritt Extrakte von den langlebigen Würmern herstellen und diese dann zu den Extrakten kurzlebiger oder normaler Würmer geben. Interessant ist dann, ob wir im Reagenzglas ebenfalls eine verstärkte Bildung von Aggregaten auslösen können. Sollte dies der Fall sein, könnten wir aus diesen Extrakten den Wirkstoff isolieren und identifizieren. Da wir den Verdacht haben, dass dies etwas mit den kleinen Hitzeschockproteinen zu tun hat, werden wir diese natürlich besonders betrachten.
Sie forschen in Ihrem Labor an chemischen Substanzen, die sich in Zukunft vielleicht als Medikamente gegen Alzheimer, Parkinson und Chorea Huntington eignen. Könnte sich eine Auflösung der Proteinablagerungen als kontraproduktiv – wenn nicht als gefährlich – erweisen?
Die molekularen Chaperone könnten dazu genützt werden, um die Bildung von toxischen Aggregaten zu verhindern oder diese zu verlangsamen. Dabei geht es weniger darum, dass bereits entstandene, große Aggregate wieder auflöst werden. Denn da müsste man in der Tat sehr vorsichtig sein. Sonst besteht die Gefahr, dass wieder toxische Formen erzeugt werden.
Denkbar wäre es auch, einen Prozess zu aktivieren, der verstärkt Oligomere in größere Aggregate zusammenzieht. Sollte es in Zukunft eine medikamentöse Therapie geben, müsste man mit einer Behandlung früh beginnen, da die zellulären Schutzmechanismen im Alter immer schwächer greifen.
Inwieweit sind ihre Erkenntnisse über das Altern von Würmern überhaupt auf Säugetiere und den Menschen übertragbar?
Der Mensch altert - wie die meisten Säugetiere auch - nicht abrupt nach der reproduktiven Phase. Möglicherweise laufen die beschriebenen Prozesse auch bei uns ab, jedoch in langsamer und moderater Form. Darüber hinaus führen die genetischen Eigenschaften, die man bei Würmern verändern muss, um langlebige Tiere zu erzeugen, auch bei Mäusen zu einer längeren Lebensspanne. Auch im menschlichen Gehirn sind im Alter eine Klasse von Chaperonen besonders aktiv: Und das sind wiederum diese kleinen Hitzeschockproteine.
Das Interview führte Barbara Abrell