Genetische Umprogrammierung von Herzmuskelzellen lässt Herz regenerieren
Vorübergehende Expression von Stammzellfaktoren ermöglicht Regeneration im Mäuseherz
Das menschliche Herz hat nur geringe Selbstheilungskräfte und eine begrenzte Regenerationsfähigkeit. Ein geschädigter Herzmuskel und der daraus resultierende Funktionsverlust können in der Regel nicht vollständig wiederhergestellt werden. Grund hierfür ist, dass Herzmuskelzellen im ausgewachsenen Organismus ihre Teilungsfähigkeit weitestgehend verloren haben. Wissenschaftler vom Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim ist es nun gemeinsam mit einem internationalen Forscherteam gelungen, mit Hilfe einer zeitlich und räumlich kontrollierten Umprogrammierung von Herzmuskelzellen in Mäusen die Regeneration des geschädigten Organs zu ermöglichen. Kritisch hierfür ist die kontrollierte Stärke und Dauer der Umprogrammierung: ist diese nicht optimal, bleibt die Regeneration aus oder es bilden sich sogar Tumore.

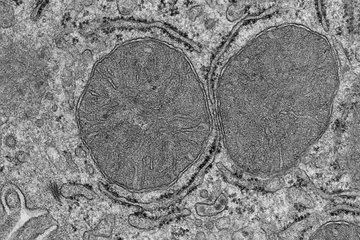
Das gesunde Herz enthält einen Verband von kaum teilungsunfähigen Herzmuskelzellen. Lediglich vereinzelt werden Herzmuskelzellen während der Lebenszeit eines Menschen langsam ausgetauscht.
Mitte: Bei einem Herzinfarkt werden durch den Verschluss von Herzkranzgefäßen Herzmuskelzellen nicht mehr ausreichend mit Sauerstoff und Nährstoffen versorgt, was zu ihrem Absterben führt. Um die hieraus entstehende Lücke im Zellverband zu schließen, bildet sich eine bindegewebige Narbe.
Rechts: Durch kurzeitige, kontrollierte Expression von regulativen Faktoren (OSKM: = Oct4, Sox2, Klf4, c-Myc) kommt es zu einer partiellen Reprogrammierung von Herzmuskelzellen. Die sich teilenden Herzmuskelzellen füllen die durch den Herzinfarkt entstandene Lücke wieder auf, das Herz regeneriert sich und eine Narbenbildung wird vermieden
Das Säugerherz ist ein Hochleistungsorgan. Zuverlässig und an den jeweiligen Bedarf angepasst pumpt es Blut mit einem relativ hohen Druck durch den Körper. Man nimmt an, dass im Laufe der Evolution diese Leistungsfähigkeit dadurch erkauft wurde, dass die Regenerationsfähigkeit des Organs weitestgehend verloren ging. Der Grund dafür könnte darin liegen, dass die einzelnen Herzmuskelzellen permanent und sehr eng zu einem sogenannten elektrischen Synzytium verbunden sind. Dabei sind die einzelnen Zellen über Zell-Zell-Kontakte miteinander verschaltet, so dass für die Herzkontraktion notwendige elektrische Erregungsleitung kontrolliert verlaufen kann. Neue, durch Zellteilung hervorgehende Herzmuskelzellen könnten diesen physiologischen Vorgang stören und das Herz außer Takt bringen. Entsprechend findet man im Herzen anders als in Organen mit hoher Regenerationsfähigkeit keine teilungsfähigen, regenerativen Stammzellen. Der Nachteil: Werden Teile des Herzmuskels geschädigt, wie dies beispielsweise bei einem Herzinfarkt der Fall ist, fehlen dem Herzen die Selbstheilungskräfte. Eine funktionelle Regeneration des geschädigten Herzens findet deshalb in der Regel nicht statt.
Teilungen von Herzmuskelzellen sind äußerst selten. Wenn dies jedoch geschieht, ist dies mit der Anschaltung von Genen verbunden, die sonst nur in der frühen Herzentwicklung exprimiert werden. Mit anderen Worten: Herzmuskelzellen spulen ihr Entwicklungsprogramm unter bestimmten Bedingungen zurück bzw. dedifferenzieren. Dabei wird, ähnlich wie bei der vorgeburtlichen Entwicklung, ein Zustand erreicht, der eine Teilung von Herzmuskelzellen prinzipiell erlauben sollte. Leider läuft das Zurückspulen bis hin zu einem frühen noch regenerationsfähigen Zustand nur inkomplett ab, ähnlich einem Tonband, das sich bei Zurückspulen verhakt. Als Folge hiervon hakt auch die Regeneration.
Cocktail aus vier Faktoren
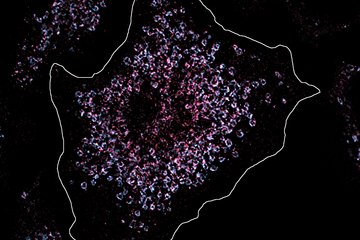
Wissenschaftler aus der Abteilung „Entwicklung und Umbau des Herzens“ am Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim haben nun an Mäusen untersucht, ob mittels einer forcierten temporären Umprogrammierung von Herzmuskelzellen ein geschädigter Herzmuskel regeneriert werden kann. „Unser Ansatz war zunächst, mittels eines Cocktails von vier Stammzellfaktoren Herzmuskelzellen so umzuprogrammieren, dass sie zunächst dedifferenzieren und dadurch die Zellteilung angeschoben wird“, erläutert Johnny Kim, der zusammen mit Thomas Braun die Studie leitete. Dafür verwendete die Gruppe transgene Mäuse, bei denen die Bildung der als OSKM abgekürzten Faktoren Oct4, Sox2, Klf4 und c-Myc gezielt im Herz an- und abgeschaltet werden kann. Die künstliche Produktion von OSKM ermöglicht u.a. die Reprogrammierung von Körperzellen in induzierte pluripotente Stammzellen (iPS-Zellen), aus denen alle Zelltypen des erwachsenen Körpers entstehen können. Für die Entwicklung induzierter pluripotenter Stammzellen durch die OSKM-Aktivierung erhielt der Entdecker des Vorgangs, Shin’ya Yamanaka, 2012 den Nobelpreis für Physiologie oder Medizin.
„Wir haben die Technologie der Reprogrammierung an kultivierten Herzmuskelzellen, die wir zuvor aus Mäusen isoliert hatten zunutze gemacht. Es gelang uns, die OSKM-Expression in Herzmuskelzellen gezielt anzuschalten. Dadurch dedifferenzierten die Herzmuskelzellen kontinuierlich weiter und erlangten dabei allmählich ihre Teilungsfähigkeit zurück“, so Kim. Daraufhin untersuchten die Forscher an den Mäusen selbst, auf welche Weise sich das Anschalten der OSKM-Expression im Herz auswirkt. „Tatsächlich konnten wir nach sechs Tagen Veränderungen am Herzen sehen, unter anderem erste Umbauprozesse am Muskel und Veränderungen an der Aktivität einer Vielzahl von Genen, allen voran Gene, die an der Zellteilung und an der Stoffwechselkontrolle beteiligt sind. Die Herzfunktion blieb jedoch erhalten, wenn OSKM nach einer Woche wieder ausgeschaltet wurden.“ Eine längere OSKM-Expression führte allerdings zu wesentlichen unumkehrbaren Veränderungen in den Herzen bis hin zu einer Beeinträchtigung der Funktion. „Wurde die OSKM Expression permanent aufrechterhalten, dedifferenzierten die Herzmuskellzellen soweit, dass sie ihre ursrpüngliche Identität komplett verloren hatten und es bildeten sich sogar Herztumoren“ so Yanpu Chen, Erstautor der Studie.
Reparatur am Herzen
Mit diesen Vorbefunden, dass es prinzipiell möglich ist Dedifferenzierung und somit die Teilung der Herzmuskelzellen zu kontrollieren, untersuchten die Wissenschaftler, ob auch Reparaturprozesse am geschädigten Herz ausgelöst werden können. „In einem Infarktmodell stellten sich mit kontrolliert eingeschalteter OSKM-Expression Regenerationsprozesse ein. Im Vergleich zu Kontrolltieren war die Infarktnarbe deutlich kleiner“, sagte Kim. Auch eine wiederholte Messung der Herzfunktion über einen längeren Zeitraum zeigte, dass sich eine Verbesserung der Herzleistung einstellte, wenn die OSKM-Expression vor oder kurz nach einem Myokardinfarkt kurzzeitig eingeschaltet wurde.
Nach Auffassung von Thomas Braun, Direktor am Max-Planck-Institut, demonstriert die Studie, dass die therapeutische Wiederherstellung von Organfunktionen in Geweben mit geringer Regenerationsfähigkeit erfolgreich sein kann, wenn teilungsunfähigen Zellen ihre Teilungsfähigkeit zurückgegeben wird. „Die Tatsache, dass wir unter bestimmten Voraussetzungen Tumorwachstum am Herzen beobachtet haben, zeigt aber auch, dass es bis zur klinischen Anwendung noch ein weiter Weg ist. Unsere Befunde weisen auf einen natürlichen Gegensatz von Regeneration und Krebsentstehung hin. Gut regenerierende Organe mit hoher Zellteilungsrate zeigen ein hohes, schlecht regenerierende wie das Herz ein niedriges Krebsrisiko. Wird therapeutisch die Regenerationsfähigkeit erhöht, steigt auch das Krebsrisiko. Leider ist nichts im Leben umsonst."
MPI-HLR