Zellbasiertes Verfahren für die Neubildung von Myelin
Direkte Reprogrammierung von Perizyten in Oligodendrozytenvorläufern als mögliche Grundlage für zellbasierte Therapiestrategie
Nervenzellen leiten ihre Signale an andere Nervenzellen über ihre Nervenzellfortsätze (Axone) weiter. Eine Isolationshülle, die die Axone spiralförmig umwickelt, erhöht die Geschwindigkeit der elektrischen Impulse enorm. Dies ist wichtig für die Verarbeitung der Signale im Gehirn und die Weiterleitung an den Körper über die peripheren Nervenbahnen. Die Isolationshülle besteht aus einer lipidreichen Membran namens Myelin und wird von sogenannten Oligodendrozyten gebildet. Ist die Myelinschicht beschädigt, wie es bei demyelinisierenden Erkrankungen der Fall ist, kommt es zum Verlust der Leitungsfähigkeit. Die Folgen sind gravierend und irreversibel.
Weltweit forschen Wissenschaftler an verschiedenen zellbasierten Strategien, um die Myelinschicht regenerieren zu können. Es läge auf der Hand, zur Remyelinisierung der Axone Oligodendrozyten zu transplantieren. Allerdings können transplantierte reife Oligodendrozyten das nicht. Neues Myelin kann nur nach Transplantation von undifferenzierten Vorläuferzellen der Oligodendrozyten (OPCs, „oligodendrocyte precursor cells“) gebildet werden.
Dank der sogenannten iPS-Technologie ist es möglich, Zellen eines Typs in andere Zelltypen zu verwandeln. Tatsächlich konnten Wissenschaftler embryonale Hautzellen von Mäusen und Ratten zunächst in iPS-Zellen (induzierte pluripotente Stammzellen) reprogrammieren und diese in Vorläuferzellen von Oligodendrozyten (induzierte oligodendrocyte precursor cells - iOPCs) ausreifen lassen. Doch die Reprogrammierung ist ineffizient, und die resultierenden Zellen vermehren und differenzieren sich nicht ausreichend.
Perizyten als Ausgangszellen
Einem internationalen Forscherteam aus zehn Laboratorien unter der Leitung von Hans Schöler vom Max-Planck-Institut für molekulare Biomedizin in Münster und um Kee-Pyo Kim, der inzwischen als Assistant Professor am College of Medicine der Catholic University of Korea tätig ist, ist es nun gelungen, diese Hürden zu überwinden. Anstelle von Hautzellen verwendeten die Forscherinnen und Forscher Perizyten als Ausgangszelltyp. Perizyten umhüllen die kapillaren Endothelzellen und bilden einen integralen Bestandteil der Blut-Hirn-Schranke.
„Perizyten und Oligodendrozyten-Vorläuferzellen entstehen während der Entwicklung aus der gleichen Zellpopulation“, sagt Kee-Pyo Kim, Erstautor der Studie. „Daher nahmen wir an, dass sich Perizyten für diese Reprogrammierung und anschließende Differenzierung in Oligodendrozyten-Vorläuferzellen gut eignen“, fährt Kim fort. „Wenn ein Umwandlungsprozess direkter und einfacher ist, wäre er effizienter und damit für spätere Zelltherapien interessanter“, erläutert Kim die Überlegungen des Teams. „Die Ausgangszellen haben nämlich ein Gedächtnis ihrer ursprünglichen Identität“, so Kim. Das Gedächtnis besteht aus dem sogenannten Transkriptom, also allen RNA-Molekülen, die zu einem bestimmten Zeitpunkt in der Zelle vorhanden sind, und aus epigenetischen Markern, den posttranslationalen Modifikationen der DNA, die die Genaktivität regulieren. "Wenn weniger umprogrammiert werden muss, ist der Umwandlungsprozess leichter zu bewerkstelligen“, erklärt Kim.
Tatsächlich konnten die Forscherinnen und Forscher Perizyten in Vorläuferzellen von Oligodendrozyten verwandeln. „Unsere aus Perizyten gewonnenen iOPCs können effizient vermehrt und in myelinisierende Oligodendrozyten differenziert werden“, so Kim. „Dazu brauchten wir nicht drei Transkriptionsfaktoren, wie bei der Produktion von iOPCs aus Hautzellen gezeigt worden ist, sondern nur zwei Faktoren: Die Überexpression von Olig2 und Sox10 reichte aus, um iOPCs zu erhalten“, sagt Kim.
Transplantation ins Gehirn
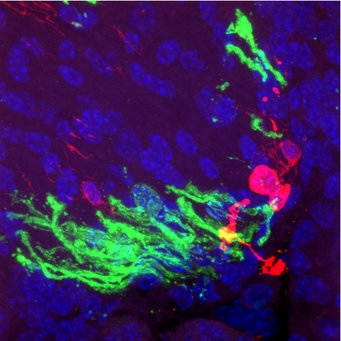
Um zu erfahren, ob und wie diese iOPCs in vivo, also im Gehirn selber zu myelinproduzierenden Oligodendrozyten ausreifen, transplantierten sie die iOPCs in das Gehirn von Shiverer-Mäusen. Das sind Mäusen, die die sogenannte Shiverer-Mutation im MBP-Gen besitzen. Die Mutation bewirkt, dass das für die Myelinscheide wichtige Myelin-Basische Protein (MBP) nicht gebildet wird. Deshalb entwickeln Shiverer-Mäuse innerhalb weniger Wochen nach der Geburt einen charakteristischen „zitternden" Gang und werden häufig als Tiermodelle für Leukodystrophie verwendet. Ins Rückenmark oder ins Gehirn von Shiverer-Mäusen transplantiert, konnten die aus Perizyten hergestellten iOPCs nachweislich eine Myelinisierung der Axone auslösen. Diese kritischen Experimente wurden in dem Laboratorium von Steve Goldman von der University of Rochester, U.S.A., durchgeführt, der dieses Modell in Jahre 2008 entwickelte.
„OPCs differenzieren in Oligodendrozyten, die normalerweise Axone mit einer Myelinscheide umhüllen. Wir transplantierten die iOPCs in die Gehirne von Shiverer Mäuse, die ihre Axone nicht myelinisieren können. Die meisten iOPCs verwandelten sich aber zu unserer Überraschung nach der Transplantation wieder in Perizyten und siedelten sich auf Blutgefäßen an“, sagt Kim. „Das zeigte uns, dass die iOPCs tatsächlich ein Gedächtnis ihrer zellulären Herkunft bewahren, was sie letztlich an der in vivo-Myelinisierung hindert.“
Die iOPC verwandeln sich also nicht automatisch in myelinproduzierende Oligodendrozyten, sondern brauchen dafür einen extra Anschub. Daher differenzierten die Forscher iOPCs in vitro weiter zu Prä-Oligodendrozyten. Aus ihnen entstehen sowohl in vivo als auch in vitro die myelinproduzierenden Oligodendrozyten.
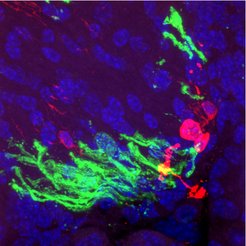
Wenn iOPCs zu Prä-Oligodendrozyten vordifferenziert und dann in das Gehirn von Shiverer-Mäusen transplantiert wurden, konnten Axone mit einer Myelinscheide umhüllt werden: „Die in vivo-Myelinisierung war zwölf Wochen nach der Transplantation besonders deutlich, und wir fanden nur selten Zellen, die sich in Perizyten zurückverwandelt hatten“, sagt Kim. „Im Vergleich zu primären OPCs – nativen, aus dem Gewebe stammenden OPCs – fanden wir keine Unterschiede in der Myelinisierungsfähigkeit“, bestätigt Kim das positive Ergebnis. „Mit dieser Studie haben wir eine effektive Strategie zur Erzeugung einer iOPC-Population etabliert, die hochgradig expandierbar und funktionell ist“, fasst Kim zusammen. „Dieser Ansatz überwindet eine wichtige Einschränkung, die ihre therapeutische Anwendung behindert hat“, so Kim.
Für spätere Therapieansätze werden nämlich viele Zellen benötigt; eine expandierbare Ausgangszellpopulation ist somit unabdingbar. „Unsere Studie zeigt deutlich, dass man in der Entwicklung von zellbasierten Therapieansätzen das Spenderzellgedächtnis im Blick haben muss“, sagt Hans Schöler. „Um das therapeutische Potenzial von direkt umgewandelten Zellen nutzen zu können, muss weiter untersucht werden, wie verschiedenen Reprogrammierungsmethoden das Spenderzellgedächtnis beeinflussen und ob man die zelluläre Identität hin zum Wunschzelltyp zum Beispiel mit chemischen Wirkstoffen lenken und stabilisieren kann.“