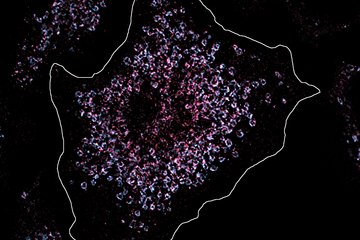
Rudelbildung am Tumorherd
Forscher können anhand der Zahl von Fresszellen im Tumorgewebe den Verlauf von Lungenkrebs vorhersagen

Komplexe Nachbarschaftsbeziehungen. Die mittels der sogenannten Multiplex-Immunfluoreszenzmikroskopie sichtbar gemachten Tumorzellen und unterschiedlichen Makrophagenpopulationen (links) wurden einer aufwändigen Lageanalyse unterzogen (rechtes Schema). Im Schema sind Tumorzellen grün, tumorhemmende Makrophagen blau und tumorfördernde Makrophagen rot dargestellt.
Immunzellen beeinflussen maßgeblich die Entwicklung von Tumoren. Dabei können sie das Tumorwachstum je nach Zelltyp sowohl fördern als auch hemmen. Dies gilt insbesondere für eine Gruppe von Makrophagen, die sich im Tumorzentrum oder den Randbereichen in teilweise hoher Zahl ansammeln. Je nach Aktivierungszustand können diese sogenannten Tumor-assoziierten Makrophagen den Verlauf der Erkrankung positiv oder negativ beeinflussen.
Wissenschaftler des Max-Planck-Instituts für Herz- und Lungenforschung und der Justus-Liebig-Universität in Gießen haben entdeckt, dass aus der Ansammlung einer Subpopulation der Tumor-assoziierten Makrophagen in einer bestimmten Region Rückschlüsse über den weiteren Verlauf der Tumorerkrankung getroffen werden können. Rajkumar Savai, Projektleiter in der Abteilung „Entwicklung und Umbau der Lunge“ und Mitglied im Zentrum für Innere Medizin der Justus-Liebig-Universität erklärt: „Man kann bei Lungentumoren in der Regel das Zentrum des Tumors vom Rand abgrenzen. Weil dort besonders viele Immunzellen einwandern, bezeichnen wir dieses Gebiet als invasiven Tumorrand.“
Für ihre Studie verwendeten die Forscher eine aufwändige Mikroskopiertechnik, die sogenannte Multiplex-Immunfluoreszenzmikroskopie. Die dadurch eindeutig identifizierbaren Makrophagen haben sie einer Analyse ihrer jeweiligen Entfernung zu benachbarten Tumorzellen unterzogen. Zusätzlich teilten die Max-Planck-Forscher anhand bestimmter Eigenschaften die Zellen in tumorfördernde und tumorhemmende Tumor-assoziierte Makrophagen ein.
Unterschiede zwischen Rand und Zentrum
„Wir haben festgestellt, dass vor allem im invasiven Randbereich des Tumors mehr tumorfördernde Zellen zu finden waren als tumorhemmende. Zudem lagen diese näher bei den Tumorzellen“, so Savai. „Anhand von Gewebeproben von mehr als hundert Patienten konnten wir dann ein Muster erkennen.“ Demnach war die Überlebensrate bei Lungenkrebspatienten insbesondere dann geringer, wenn die tumorfördernden Makrophagen in den invasiven Randbereichen besonders eng an den Tumorzellen lagen und gleichzeitig tumorhemmende Makrophage weiter entfernt waren. Auch die Zellzahl hatte einen Einfluss auf die Prognose der Patienten: „Wenn im Zentrum des Tumors weniger tumorhemmende Makrophagen vorhanden waren, hatten die Patienten eine geringere Überlebenswahrscheinlichkeit. Insgesamt fanden wir mehr tumorfördernde als tumorhemmende Makrophagen“, so Savai.
Dass tumorfördernde und tumorhemmende Makrophagen tatsächlich unterschiedliche Aktivitätsmuster besitzen, zeigte sich, als die Bad Nauheimer Wissenschaftler die RNA der Zellen sequenzierten. „Wir stellten bei den beiden Zellvarianten, auch im Vergleich mit Makrophagen von außerhalb der Tumorgewebe, stark unterschiedliche Genexpressions-Profile fest“, Savai. Dabei identifizierten die Forscher auch fünf Kandidaten für Biomarker, mit deren Hilfe sich die Überlebenswahrscheinlichkeit bei Lungenkrebs vorhersagen lassen könnte. „Diese Biomarker könnten sich für die individuelle Behandlungsstrategie der Lungenkarzinompatienten als sehr hilfreich erweisen“, betont Friedrich Grimminger, Leiter des Gießener Lungentumorzentrums und Direktor der Medizinischen Klinik IV/V der Justus-Liebig-Universität. „Wir haben basierend auf charakteristischen Genexpressionsprofilen der Tumor-assoziierten Makrophagen in dieser Studie zudem Faktoren identifiziert, die sich als neue Zielstrukturen für spezifische Therapieansätze anbieten“, ergänzt Werner Seeger, Direktor der Abteilung „Entwicklung und Umbau der Lunge“ am Max-Planck-Institut und der Medizinischen Klinik II der Justus-Liebig-Universität.
MH