Patisiran erhält FDA-Zulassung
Das erste RNAi-Medikament beruht auf einer Technologie, die am Max-Planck-Institut für biophysikalische Chemie entwickelt wurde
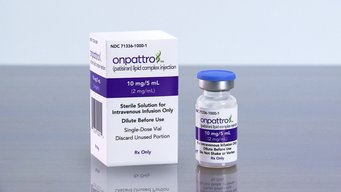
Die US-amerikanische Arzneimittelzulassungsbehörde FDA hat den RNA-Interferenz (RNAi)-Wirkstoff Patisiran zur Behandlung einer Polyneuropathie bei hereditärer Transthyretin-vermittelter Amyloidose (hATTR) bei Erwachsenen zugelassen. Das Medikament Onpattro des Herstellers Alnylam ist die erste und einzige von der FDA zugelassene Behandlung für diese Erkrankung. Die Therapie gründet unter anderem auf von der Max-Planck-Gesellschaft patentierten Forschungsergebnissen, die Alnylam von der Technologietransferorganisation Max-Planck-Innovation exklusiv in Lizenz zur Verfügung gestellt wurden.

Bei der hereditären Transthyretin (TTR)-vermittelten Amyloidose handelt es sich um eine durch Mutationen im TTR-Gen hervorgerufene Erbkrankheit, die zu einer fortschreitenden Behinderung und häufig zum Tod führt. Das TTR-Protein wird hauptsächlich in der Leber produziert und ist normalerweise ein Vitamin A-Träger. Mutationen im TTR-Gen führen dazu, dass sich krankhaft veränderte Amyloidproteine ansammeln und Organe und Gewebe schädigen, beispielsweise das periphere Nervensystem und das Herz. Dies kann eine schwer behandelbare periphere sensible Neuropathie, eine autonome Neuropathie und/oder eine Kardiomyopathie zur Folge haben. Die Lebenserwartung eines Patienten liegt im Schnitt vom Zeitpunkt der Diagnose bei weniger als fünf Jahren. Bislang standen Patienten in den USA keine von der FDA zugelassenen Behandlungsoptionen zur Verfügung.
RNAi (RNA-Interferenz) ist ein natürlicher zellulärer Prozess der Genabschaltung und stellt aktuell eine der vielversprechendsten und sich am raschesten weiterentwickelnden Forschungsgebiete in der Biologie und Medikamentenentwicklung dar. Für die Entdeckung dieses Prozesses erhielten Wissenschaftler im Jahr 2006 den Medizinnobelpreis. Thomas Tuschl und seine Mitarbeiter vom Max-Planck-Institute für Biophysikalische Chemie in Göttingen konnten belegen, dass dieser Mechanismus auch bei Säugetieren und damit beim Menschen wirksam ist.
Das Unternehmen Alnylam ist der exklusive Inhaber der Lizenz zur therapeutischen und diagnostischen Anwendung der bahnbrechenden Patente der Max-Planck-Gesellschaft, die einen zentralen Bestandteil des Technologieportfolios des Unternehmens in Bezug auf Entwicklung, Herstellung und Vertrieb von RNAi-Therapeutika darstellen. Die sogenannte Small Interfering RNA (siRNA) – die RNAi vermittelnden Moleküle, die Teil der RNAi-Therapieplattform von Alnylam sind – setzt an einem früheren Punkt der Erkrankung an, als es die heutigen Medikamente tun, indem sie Boten-RNA (mRNA), die genetische Vorstufe, die krankheitsauslösende Proteine codiert, wirksam abschaltet und so die Herstellung dieser Proteine verhindert. Hierbei handelt es sich um einen revolutionären Ansatz bei der Entwicklung von Medikamenten zur Verbesserung der Behandlung von Patienten mit genetischen und anderen Erkrankungen.
Wirkstoff stoppt die Erkrankung
Die Zulassung von Onpattro basiert auf positiven Ergebnissen der randomisierten, doppelblinden, placebokontrollierten, globalen Phase III-APOLLO-Studie, der größten jemals durchgeführten Studie mit an Polyneuropathie leidenden hATTR-Amyloidose-Patienten. In dieser Studie wurden die Sicherheit und Wirksamkeit in einer vielschichtigen, globalen Population von hATTR-Amyloidose-Patienten in 19 Ländern, die insgesamt 39 TTR-Mutationen aufwiesen, beurteilt. „Die Zulassung durch die FDA stellt einen völlig neuen Ansatz für die Behandlung von Patienten mit Polyneuropathie bei hATTR-Amyloidose dar und könnte eine vielversprechende neue Ära der Patientenversorgung einleiten“, so John Berk, von der Boston University School of Medicine und stellvertretender Direktor des dortigen Amyloidose-Zentrums. „Angesichts der hohen Aussagekraft der APOLLO-Daten, einschließlich der Daten, die zeigen, dass sich die Krankheitsprogression bei vielen Patienten aufhalten oder verbessern lässt, stellt das Medikament für Patienten mit dieser Erkrankung eine enorme Verheißung dar.“
„Es freut uns außerordentlich, dass es Alnylam als Ausgründung der Max-Planck-Gesellschaft gelungen ist, das allererste RNAi-basierte Arzneimittel auf den Markt zu bringen. Als erstes von der FDA zugelassenes Medikament gegen die schwere Krankheit hATTR-Amyloidose kann das neue Medikament vielen Patienten in den USA und – nachdem das Unternehmen die Zulassung von Patisiran durch andere Zulassungsbehörden beantragt – hoffentlich bald in der ganzen Welt Linderung verschaffen. „Da Alnylam über eine solide therapeutische Pipeline mit verschiedenen RNAi-Kandidaten in weit fortgeschrittenen Stadien verfügt, freuen wir uns darauf, bald weitere Medikamente auf der Grundlage von RNAi auf dem Markt zu sehen“, meint Jörn Erselius, CEO bei Max Planck Innovation, der Technologietransferorganisation der Max-Planck-Gesellschaft.