Was Termiten und Zellen gemeinsam haben
Synthetische Zelle mit lebensähnlichen Eigenschaften offenbart grundlegende Prinzipien der Morphogenese und zellulären Wahrnehmung
Die Natur ist voll von faszinierenden Mustern. Pflanzen zeigen spiralförmiges Wachstum, regelmäßig angeordnete Blätter und Blüten, Tiere beeindrucken uns mit ihren gestreiften oder gepunkteten Fellen und soziale Insekten bauen komplexe Neststrukturen. Diese nahezu perfekt angeordneten Muster bilden sich scheinbar ohne Bauplan, ein Phänomen, das auch bei der Morphogenese, der Entstehung von neuen Zell- und Körperformen zu beobachten ist. Mit der Erschaffung einer künstlichen, lebensähnlichen Protozelle, die externe Reize in Formveränderungen umsetzen kann, hat das interdisziplinäres Forscherteam unter der Leitung von Philippe Bastiaens, Direktor am Max-Planck-Institut für molekulare Physiologie in Dortmund, nun zum ersten Mal zeigen können, dass die gleichen selbstorganisierenden Prozesse, die den Bau eines Termitenhügels steuern, auch die Entwicklung von Zellformen bestimmen. Dabei führt die kollektive Dynamik nanometergroßer Makromoleküle zur Selbstorganisation mikrometergroßer Muster. Die Wechselbeziehung von Informationsverarbeitung und Form, die durch die verformbare Plasmamembran vermittelt wird, ist ein grundlegendes Merkmal lebender Zellen und ermöglicht es ihnen, auf eine sich ständig verändernde Umgebung in Abhängigkeit von ihren bisherigen Erfahrungen zu reagieren.
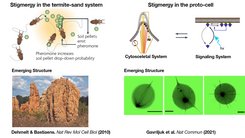
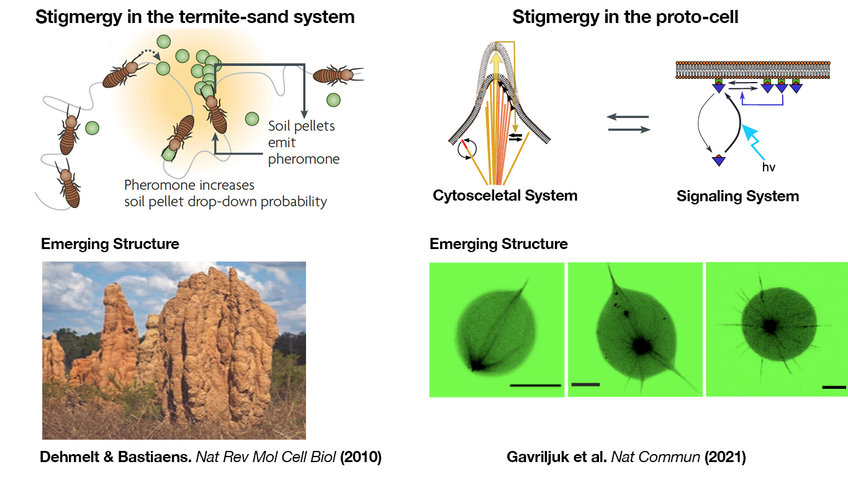
Scheinbar kopflos krabbeln Tausende von Termiten über den Boden, tragen Sandkörner und lassen sie wieder fallen. Und obwohl die Termiten keinen Bauplan haben, entsteht wie aus dem Nichts ein regelmäßiges Muster von Sandsäulen. In diesem Termiten-Sand-System liefern die Termiten die Energie, um den Sand in ein lebendiges, dynamisches Gebäude umzustrukturieren, das in ständiger Verbindung mit einer sich wandelnden Umgebung steht.
Bastiaens' interdisziplinäre Gruppe von Biochemikern und angewandten sowie theoretischen Physikern hat nun gezeigt, dass eine sehr ähnliche Situation der Selbstorganisation in unseren Zellen auftritt, die chemisches Potenzial als Energiequelle nutzen, um dynamisch aufrechterhaltene Strukturen zu erzeugen, die aus Molekülen statt aus Sandkörnern bestehen. Der aus dem Gleichgewicht geratene, energetisierte Zustand, der dieses kollektive Verhalten ermöglicht, ist eine Eigenschaft der lebenden Materie, um eine dynamisch aufrechterhaltene Identität in einer sich ständig verändernden Welt zu erzeugen und zu stabilisieren.
Wie aus scheinbarem Zufall Formen entstehen
Ein Merkmal von selbstorganisierenden Prozessen sind zufällige Fluktuationen, die durch lokale Wechselwirkungen zwischen beteiligten Elementen verstärkt werden können. Wenn zum Beispiel Termiten umherwandern, nehmen sie Sandkörner auf und lassen sie wieder fallen, was zu Schwankungen in der Dichte des Sandes führt. Während sie den Sand umhertragen, hinterlassen die Termiten jedoch einen Duftstoff auf dem Sandkorn, ein sogenanntes Pheromon. Dies führt zu einem verstärkten Wachstum von Sandhaufen, wodurch frei herumliegende Sandkörner verbraucht werden. Der Prozess der Selbstamplifikation von Strukturen, die ihre Bausteine verbrauchen, führt zu einem regelmäßigen Muster von Sandsäulen, die das Fundament des Termitenbaus bilden.
Dieses Phänomen, das auch als Stigmergie bezeichnet wird, was so viel bedeutet wie "Hinterlassen eines Zeichens während der laufenden Arbeit", wurde erstmals 1959 von dem französischen Zoologen Pierre-Paul Grassé beschrieben. Es erklärt, wie die indirekte Kommunikation sozialer Insekten über Sand zu einem kollektiven Verhalten führt, das dynamische Strukturen wie regelmäßig organisierte Sandsäulen erzeugt. Die Termitenkönigin kommuniziert mit diesem selbstorganisierenden Termiten-Sand-System, indem sie einen Pheromon-Gradienten aussendet. Dieser funktioniert als Vorlage für die Errichtung eines dynamischen Gebäudes um sie herum, das sich an ihre wachsende Größe anpasst.
Molekulare Selbstorganisation bringt Zellen in Form
Um zu untersuchen, ob die Prinzipien des kollektiven, stigmergischen Verhaltens des Termiten-Sand-Systems auch für die Selbstorganisation von Biomolekülen in der zellulären Morphogenese gelten, hat Bastiaens' Gruppe eine synthetische Protozelle mit lebensähnlichen Eigenschaften geschaffen, die auf externe Lichtsignale mit Formveränderungen reagieren kann. Dafür wurden leblose biologische Bausteine in eine verformbare Lipidmembran eingekapselt und dieser mit Zugabe der molekularen Energieträger ATP/GTP Leben eingehaucht. Dieses aus dem Gleichgewicht geratene eingekapselte molekulare System enthält ein dynamisches Zytoskelett aus Mikrotubuli und ein lichtempfindliches molekulares Signalmodul, das ähnlich wie die natürliche Signalübertragung bei der Morphogenese arbeitet.
In der zellulären Morphogenese erfolgt die Entstehung neuer Strukturen durch die Verformung der Plasmamembran durch dynamische Umlagerungen des Zytoskeletts. Extrazelluläre Morphogene lenken diesen Prozess, indem sie Rezeptoren auf der Zellmembran binden. Die Übertragung der Information in das Innere der Zelle erfolgt durch eine Neugewichtung von intrazellulären Phosphorylierungsreaktionszyklen. Dadurch werden intrazelluläre chemische Signalgradienten erzeugt, die lokal das Wachstum des Zytoskeletts fördern.
Die Wissenschaftler haben diesen Prozess nachgebildet, indem sie ein lichtempfindliches Signalsystem entwickelt haben, das eine biotechnologisch hergestellte Kinase an die Membran befördert, die die Phosphorylierungsreaktionszyklen des Tubulin-bindenden Moleküls Stathmin neu ausbalanciert. Damit konnten sie zeigen, dass das Wachstum des Zytoskeletts tatsächlich dadurch gefördert wird, dass diese Phosphorylierungszyklen wie eine molekulare Maschine funktionieren, die kontinuierlich Mikrotubuli-Bausteine zur Membran pumpt.
Stigmergie in der Morphogenese
Mit den lebensähnlichen Protozellen konnten die Wissenschaftler ihre Theorie bestätigen, dass die Bildung der Zellform den Prinzipien des stigmergischen Termiten-Sand-Systems folgt. Sowohl das Zytoskelett als auch das Signalsystem zeigen selbstorganisierende Eigenschaften, die durch Interaktionen mit der Plasmamembran zustande kommen. Bildet sich durch das lokale Wachstum des Zytoskeletts eine kleine Ausstülpung der Membran, werden dadurch weitere Mikrotubuli eingefangen, was das Wachstum der Ausstülpung immer mehr verstärkt und freie Mikrotubuli verbraucht. Im Falle des Signalsystems führt die Rekrutierung der Kinase an die Membran zu sich selbstverstärkenden Aggregaten, wodurch die freie Kinase verbraucht wird. Mehr noch, die Forschenden konnten zeigen, dass die indirekte Kommunikation zwischen dem Signal- und dem Zytoskelettsystem durch die verformbare Membran vermittelt wird und zu selbstorganisierten Formen wie sternförmigen oder polaren Strukturen führt.
Sie konnten auch zeigen, dass lokalisierte extrazelluläre Signale ähnlich wie die Pheromon-emittierende Termitenkönigin wirken, indem sie eine chemische Vorlage bereitstellen, die das selbstorganisierende Termiten-Sand-System anweist, ein dynamisches Gebäude um sie herum zu strukturieren. Im Fall der Protozellen zwingt der Signalisierungsgradient die selbstorganisierenden Lösungen der beidseitig kommunizierenden Signal- und Zytoskelettsysteme dazu, die lebensähnlichen Zellen in Richtung der extrazellulären Signale zu reorganisieren. Allerdings war die Reaktion auf die extrazellulären Signale sehr stark von der anfänglichen, selbstorganisierten Form der Protozellen abhängig, die, wie die Wissenschaftler vermuteten, aus vorherigen Erfahrungen hervorgeht.
Zelluläre Wahrnehmung
Die anfängliche Form der Zelle, so konnten die Forschenden zeigen, ist abhängig vom dynamischen Gleichgewicht der interagierenden, stigmergischen Signal- und Zytoskelettsysteme. Wenn die Verformung der Membran durch das Signalsystem gegenüber der Mikrotubuli-induzierten Membranverformung dominiert, sehen die Protozellen sternförmig aus. Im entgegengesetzten Fall zeigen die Zellen hingegen eine polare Form. Ein Änderung dieses dynamischen Gleichgewichts durch ein extrazelluläres Signal kann eine sternförmige in eine polare Zelle umformen, aber nicht umgekehrt. Dies zeigt, dass die Entwicklung der Zellform nicht nur durch Wachstumssignale von außerhalb der Zelle bestimmt wird, sondern auch durch die vorherrschende selbstorganisierte Morphologie der Zelle, die wiederum durch vorangegangene Ereignisse bestimmt wird.
„Ob die Vorerfahrungen von Zellen in einem gesunden oder kranken Gewebe eine Rolle bei der Wahrnehmung von Reizen spielen, ist eine große Frage auf dem Gebiet der Zell- und Entwicklungsbiologie. Unsere Arbeit zeigt, dass sich Zellen nicht wie einfache Input-Output-Maschinen verhalten, sondern frühere Erfahrungen in ihre Reaktion auf eine sich ständig verändernde Umgebung integrieren. In einem sich entwickelnden Gewebe besteht die Umgebung der Zellen aus anderen Zellen. Unsere selbstorganisierten Protozellen haben das Potenzial, miteinander zu kommunizieren und zwar über beidseitige mechanische Abtastung und Wahrnehmung, die aus der rekursiven Kopplung zwischen dem Signal- und dem Zytoskelettsystem hervorgeht. So könnten wir untersuchen, wie die rekursive Kommunikation zwischen selbstorganisierten molekularen Systemen innerhalb von Zellen zu einer selbstorganisierten Gewebebildung auf einer höheren Ebene führt", sieht Philippe Bastiaens in die Zukunft.