Chaperon-Proteine falten Rubisco
Ein genialer Einfall der Natur: Die Fotosynthese macht höheres Leben erst möglich. Und sie könnte auch noch mehr zur Lösung künftiger Energieprobleme beitragen – wenn sie sich optimieren ließe. Daran arbeiten Ulrich Hartl und Manajit Hayer-Hartl am Max-Planck-Institut für Biochemie.
Text: Harald Rösch

Mal ehrlich – denken Sie beim Anblick einer Wiese an eine Solaranlage? Sicher nicht. Dabei machen Pflanzen etwas ganz Ähnliches: Sie wandeln die Energie des Sonnenlichts in nutzbare Energie um. Durch Fotosynthese gewinnen sie aus der Energie des Sonnenlichts chemische Energie, indem sie über viele Zwischenschritte Zucker aufbauen. Diese Energiequelle zapfen wir heute schon an, sei es als Biosprit oder in Biogasanlagen.
Die Natur baut also bereits seit Jahrmillionen Solaranlagen. Schade nur, dass die natürlichen Kraftwerke so ineffektiv arbeiten. Denn Pflanzen sind Energieverschwender – zumindest was die Energiegewinnung bei der Fotosynthese angeht. Um Europas Treibstoffbedarf im Jahr 2050 mit Bioethanol oder -diesel zu decken, wären die Bundesrepublik und Frankreich zusammen als Anbaufläche nicht groß genug. Wenn sich allerdings zehn Prozent der Energie, die als Sonnenlicht auf diese Fläche fällt, in chemische Energie verwandeln ließe, würde eine Fläche von der Größe Baden-Württembergs vermutlich ausreichen.
Der Wirkungsgrad der pflanzlichen Fotosynthese liegt allerdings natürlicherweise nur bei rund fünf Prozent. Zum Vergleich: Heutige Solarzellen erreichen etwa 20 Prozent, produzieren aber keine Energieträger, die sich wie Bioethanol leicht speichern und transportieren lassen. Es gibt jedoch Organismen, die schaffen deutlich mehr als Pflanzen: So kann das grüne Schwefelbakterium Chlorobaculum tepidum mit seinen extrem effizienten Solarkraftwerken zur Lichtabsorption zehn Prozent des einfallenden Sonnenlichts in chemische Energie verwandeln.
Turbo-Pflanzen gewinnen mehr Energie
Wissenschaftler arbeiten deshalb daran, die Fotosynthese effektiver zu machen. Dabei wollen sie verschiedene Schritte bei der Umwandlung der Lichtenergie in chemische Energie optimieren, beispielsweise indem sie die Effizienz des Fotosynthese-Apparats erhöhen.
Solchermaßen aufgerüstete Pflanzen wären in der Lage, mehr Biomasse für die Treibstoffproduktion zu bilden. Manche Wissenschaftler wollen dagegen auf Pflanzen ganz verzichten und stattdessen Bakterien mit einem optimierten Fotosynthese-Apparat ausstatten. Möglicherweise sind Lebewesen aber auch völlig überflüssig. Wasserstoff etwa könnte sich in Bioreaktoren erzeugen lassen, in denen künstliche Fotosynthese nur mit den notwendigen Proteinen abläuft. Denn die Natur hat Enzyme hervorgebracht, die mit Sonnenenergie Wasser spalten und daher teures Platin in Brennstoffzellen ersetzen könnten. Und sie kennt auch solche, die aus den Bruchstücken des Wassers im Anschluss Wasserstoff produzieren.
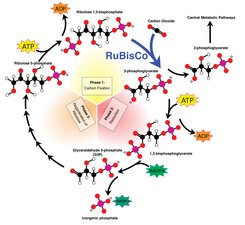
Am Max-Planck-Institut für Biochemie in Martinsried bei München suchen Forscher eine Möglichkeit, die pflanzliche Fotosynthese effektiver zu machen – und sind auf dem Weg dorthin einen wichtigen Schritt weitergekommen. Die Wissenschaftler um Ulrich Hartl und seine Frau Manajit Hayer-Hartl haben den Faltungsprozess eines Schlüsselproteins der Fotosynthese aufgedeckt, des sogenannten Rubisco. Mit diesem Wissen können die Forscher nun daran gehen, Rubisco künstlich herzustellen und es so zu verändern, dass es effizienter arbeitet.
Rubisco ist nicht nur das häufigste Protein auf der Erde, es gehört auch zu den wichtigsten: Ohne Rubisco gäbe es das Leben in seiner heutigen Form nicht. Es bindet Kohlendioxid aus der Atmosphäre und leitet die Umwandlung in Zucker und Sauerstoff ein. Rubisco arbeitet jedoch sehr langsam und ineffektiv. Es reagiert nämlich nicht nur mit Kohlendioxid, sondern auch mit Sauerstoff: Im Schnitt bindet es nach drei bis fünf Kohlendioxid-Molekülen ein Sauerstoff- Molekül. „Als Rubisco vor rund vier Milliarden Jahren entstand, war dies bedeutungslos, denn damals gab es noch keinen Sauerstoff in der Atmosphäre. Heute dagegen liegt der Sauerstoffanteil bei 20 Prozent“, sagt Manajit Hayer-Hartl, die zusammen mit ihrem Mann Ulrich an Rubisco forscht. Rubisco könnte also wesentlich effektiver arbeiten, wenn es nicht mehr mit Sauerstoff reagieren würde.
Anstandsdamen sorgen für die richtige Form
Die Martinsrieder Forscher wollen Rubisco deshalb so verändern, dass es nur noch Kohlendioxid binden kann. Zuvor müssen sie aber erst einmal wissen, wie das Protein überhaupt gebildet wird. Denn Rubisco gehört zu den größten Proteinen überhaupt und besteht aus acht großen und acht kleinen Untereinheiten. „Bei so vielen Untereinheiten ist die Gefahr groß, dass sich falsche Teile des Proteins zusammenlagern und verklumpen“, erklärt Manajit Hayer-Hartl. Damit das Protein richtig funktioniert, müssen die Aminosäureketten korrekt gefaltet und die Untereinheiten so positioniert werden, dass sie einen Zylinder bilden. Spezielle Proteine bewerkstelligen diesen komplexen Faltungsprozess, sogenannte Chaperone.

Den Forschern zufolge sind drei Proteine notwendig, um einen funktionierenden Rubisco-Komplex nachzubauen: neben den bereits bekannten Chaperonen GroEL und GroES auch ein neu entdecktes Helferprotein (RbcX). RbcX sorgt dafür, dass sich je zwei große Untereinheiten aneinanderlagern können. Vier dieser Dimere bilden dann den Zylinder, an dessen Kopfund Fußfläche sich je vier kleine Untereinheiten positionieren. „Jetzt verstehen wir, warum beispielsweise Bakterien kein funktionierendes Rubisco herstellen konnten, wenn wir nur die DNA für das Protein in das Bakterien erbgut einbauen – ohne die entsprechenden Helferproteine konnte kein funktionstüchtiges Rubisco entstehen“, sagt Ulrich Hartl.
Nun können die Wissenschaftler daran gehen, Rubisco im Labor zu produzieren. Dazu wollen sie die DNA für Rubisco sowie für die beiden Chaperone und das Helferprotein in Bakterien einschleusen. Die sich rasend schnell vermehrenden Mikroorganismen stellen das Rubisco dann in ausreichender Menge her. Mit solchen Bakterien wollen die Forscher eine effizientere Rubisco- Variante finden. „Wenn wir die Rubisco- DNA in einen Bakterienstamm einbringen, der nur mit funktionierendem Rubisco überlebt, können wir alle möglichen Mutationen im Rubisco- Gen testen und sofort sehen, wie gut die einzelnen Varianten arbeiten“, erklärt Ulrich Hartl.

Mit diesem Verfahren lassen sich auch multiple Mutationen an unterschiedlichen Stellen im Rubisco-Gen erzeugen und untersuchen. Ein wichtiger Vorteil, denn möglicherweise lässt sich das Protein durch den Austausch einer einzelnen Aminosäure nicht weiter optimieren. Dies wäre eine Erklärung für die Frage, warum die Natur Rubisco nicht selbst im Laufe der Evolution an den zunehmenden Sauerstoffgehalt der Luft angepasst hat. Manche Wissenschaftler glauben, dass die Natur bereits eine optimale Struktur für Rubisco gefunden hat und Rubisco sich gar nicht verbessern lässt. Die Martinsrieder Wissenschaftler sind da anderer Ansicht. „Das Rubisco-Molekül der Pflanzen ist definitiv nicht die bestmögliche Variante. Manche Rotalgen besitzen nämlich eine noch effizientere Form. Dies zeigt: Es geht noch besser“, ist Ulrich Hartl überzeugt.
Mutationen zu finden, die Rubisco noch spezifischer für Kohlendioxid machen, stellt allerdings nicht die einzige Herausforderung dar. Denn die neuen Ergebnisse zeigen, dass ohne die passenden molekularen Anstandsdamen gar nichts geht. Anders als Rubisco selbst arbeitet RbcX äußerst selektiv und hilft ausschließlich dem natürlichen Pflanzen-Rubisco bei der Faltung. Aus diesem Grund kann beispielsweise das Rotalgen-Rubisco bislang nicht auf Pflanzen übertragen werden – es wird dann einfach nicht korrekt gefaltet. Möglicherweise benötigt also auch eine optimierte Rubisco-Variante ihre individuellen Chaperone.
Energie mit weniger Wasser
Trotz aller Schwierigkeiten, das Ziel ist lohnend: Einerseits könnten Algen oder Pflanzen mit einer optimierten Rubisco- Variante gegen den Anstieg der Kohlendioxid- Konzentration in der Atmosphäre eingesetzt werden. Darüber hinaus wären solche Turbo-Pflanzen mit ihrem deutlich schnelleren Wachstum von großer Bedeutung für die Landwirtschaft. „Wir könnten schon von einem um 10 bis 15 Prozent effizienteren Rubisco profitieren“, so Ulrich Hartl. Dabei geht es nicht nur darum, das Wachstum von Pflanzen zu beschleunigen, sondern es in manchen Gebieten überhaupt erst zu ermöglichen. Denn eine effizientere Umwandlung von Kohlendioxid in Zucker senkt den Wasserverbrauch der Pflanze. Dadurch könnte künftig Landwirtschaft in Gebieten möglich werden, die für heutige Nutzpflanzen zu trocken sind – und solche Gebiete werden sich angesichts der zunehmenden Wasserverknappung auf der Erde weiter ausbreiten.
GLOSSAR
Chaperone (engl. chaperon: Anstandsdame)
Proteine können nur dann funktionieren, wenn ihre Aminosäureketten korrekt gefaltet sind. Ähnlich wie Anstandsdamen im 19. Jahrhundert junge Damen vor schädlichen Einflüssen bewahren sollten, sorgen spezielle Enzyme in Zellen dafür, dass Proteine nicht auf die schiefe Bahn geraten und die falsche Form annehmen. Manche Chaperone haben die Gestalt eines Fasses, in dem sich nur ein einziges Molekül falten kann. Ein Mangel an funktionstüchtigen Chaperonen kann die Verklumpung von Proteinen zur Folge haben und verschiedene Erkrankungen auslösen, etwa Alzheimer oder Chorea Huntington.
Fotosynthese
Bei der Fotosynthese werden aus Kohlendioxid und Wasser mit Hilfe von Sonnenenergie Kohlenhydrate aufgebaut. Man kann sie in zwei miteinander gekoppelte Abschnitte unterteilen: Die Lichtreak tionen (Foto-Teil) stellen Energie bereit, damit Wasser in Elektronen und Protonen sowie Sauerstoff gespalten werden kann. Die energiereichen Elektronen und Protonen werden im sogenannten Calvin-Zyklus (Synthese-Teil) dazu genutzt, Kohlendioxid in Zucker umzuwandeln.















