Wechselwirkungen zwischen Proteinen bestimmen Spezifität von Zielgenen
Protein-Protein-Interaktionen verändern lokal die Struktur der DNA und verstärken so die sequenzspezifische Bindung wichtiger Proteine
Ein grundlegendes Thema in der Pflanzenentwicklung ist die Frage, wie Proteine in regulatorischen Netzwerken zusammenarbeiten, um die Aktivität bestimmter Zielgene zu koregulieren. Eine Zusammenarbeit zwischen den Forschungsgruppen von George Coupland und Jijie Chai des Max-Planck-Instituts für Pflanzenzüchtungsforschung und der Universität zu Köln hat einen eleganten Mechanismus entschlüsselt, wie eine bestimmte Protein-Protein-Interaktion Gene in Arabidopsis durch Beeinflussung der DNA-Konformation kooperativ steuert. Die Ergebnisse haben weitreichende Auswirkungen darauf, wie Transkriptionsfaktoren in anderen Entwicklungskontexten regulatorische Spezifität erreichen können.
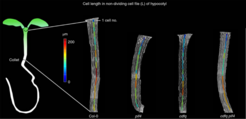
Zwei Klassen von Transkriptionsfaktoren, PHYTOCHROME-INTERACTING FACTORs (PIFs) und CYCLING DOF FACTORs (CDFs), sind an der Regulierung von Genen beteiligt, die das Pflanzenwachstum in Abhängigkeit von Licht und Temperatur steuern. Es war jedoch rätselhaft, wie die Spezifität der pflanzenspezifischen DOF-Faktoren bestimmt wird, da sie angeblich sehr kurze, einfache DNA-Sequenzen erkennen, die im Pflanzengenom häufig vorkommen.
In einer neuen Arbeit haben He Gao und Mitarbeiterinnen und Mitarbeiter aus den Labors von George Coupland und Jijie Chai sowie dem Genomzentrum am Max-Planck-Institut für Pflanzenzüchtungsforschung gezeigt, dass in der Modellart Arabidopsis thaliana zwei repräsentative Mitglieder dieser Transkriptionsfaktor-Familien, PIF4 und CDF2, zusammenarbeiten und eine Untergruppe ähnlicher Gene regulieren. Die Autorinnen und Autoren verwendeten eine leistungsstarke Kombination aus Bildgebung, Genomik und in-vitro-Biochemie, um gemeinsame Zielgene von PIF4 und CDF2 zu identifizieren. Anschließend analysierten sie im Detail die Bindung beider Proteine an ein bestimmtes gemeinsames Zielgen, YUCCA8, das für ein Enzym kodiert, das das Hormon Auxin in den Keimblättern produziert und dadurch die Streckung der Hypokotylzellen als Reaktion auf Licht fördert.
Eng beeinanderliegende CDF2-Bindungsstellen
Proteine regulieren ihre Zielgene, indem sie bestimmte kurze DNA-Sequenzen erkennen und an sie binden. Die Forschenden fanden heraus, dass im YUCCA8-Gen die einfachen CDF2-Bindungsstellen sehr eng mit denen von PIF4 beieinander liegen. Sie stellten außerdem fest, dass PIF4 und CDF2 in vitro physisch miteinander interagieren und PIF4 die Fähigkeit von CDF2 zur Bindung an die YUCCA8-DNA erhöht. In Pflanzen, in denen PIF4 inaktiviert ist, war die Bindung von CDF2 an seine Zielgene, einschließlich YUCCA8, in vivo stark reduziert. Neben der Erkennung eines bestimmten DNA-Sequenzmotivs wird die Stärke und Spezifität, mit der regulatorische Proteine ihre Zielsequenzen binden können, auch durch die lokale Konformation der DNA an der Zielstelle bestimmt, die festlegt, wie zugänglich die Bindesequenz für die Proteinbindung ist.
Die Forschenden führten eine Reihe von Experimenten durch, bei denen sie die DNA-Bindungsstellen von PIF4 und CDF2 in YUCCA8 mutierten und in vitro bestätigten, welche Teile der beiden Proteine miteinander interagieren, und sie schlugen einen Mechanismus vor, der erklärt, wie PIF4 und CDF2 gemeinsam die Expression von YUCCA8 aktivieren können. Sie wiesen nach, dass vier PIF4-Proteine zu einem Komplex aus zwei PIF4-Dimeren assoziiert sind und dass dieser Komplex, wenn er an seine DNA-Zielstellen bindet, die Konformation der DNA lokal verändert. Die Interaktion von PIF4 mit CDF2 verstärkt dann die Bindung von CDF2 an seinen Bindungsstellen, die sich in der Nähe der PIF4-Bindungsstellen befinden.
In Zukunft können diese Studien erweitert werden, um festzustellen, ob die Analyse der Zusammenarbeit von PIF4 und CDF2 an YUCCA8 ein allgemeines Modell dafür liefert, wie beide Proteine andere Genziele regulieren, und um ihre Zusammenarbeit in vivo während der Hypokotylverlängerung zu untersuchen. Ein wichtiger Aspekt der Studie ist die Aufklärung eines spezifischen Mechanismus, der erklärt, wie Protein-Protein-Wechselwirkungen die sequenzspezifische DNA-Bindung einer wichtigen Klasse von pflanzenspezifischen Proteinen verstärken können, indem sie die lokale DNA-Konformation verändern, um die Genexpression in einem spezifischen Entwicklungskontext zu aktivieren.












