Nachbarschaftshilfe im Gewebe
Max-Planck-Forscher finden heraus, was die Bewegung von Fresszell-Netzwerken steuert
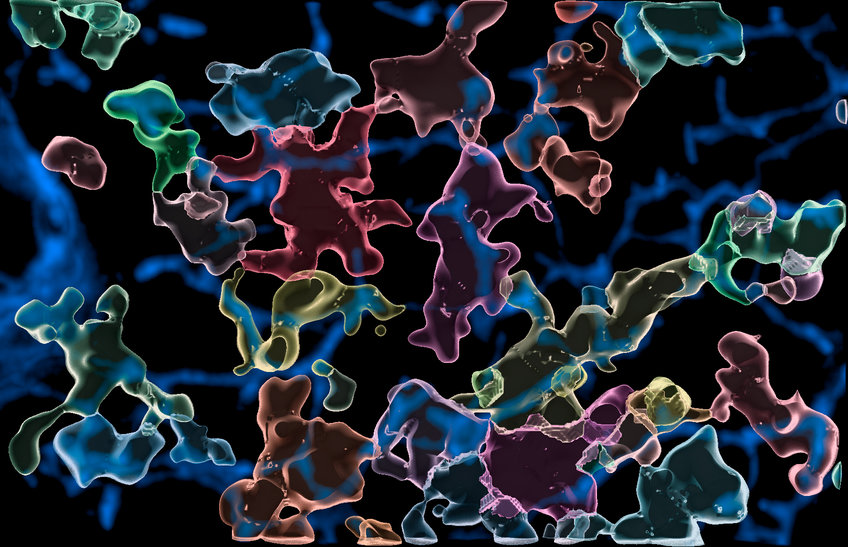
Makrophagen sind Immunzellen im Körper, die abgestorbene Zellen und Mikroben entfernen. Dafür bilden sie in den Geweben aller Organe große Netzwerke aus vielen Einzelzellen, die nach Anzeichen einer Infektion suchen und eingedrungene Erreger zerstören. Wie genau sich Makrophagen in Geweben fortbewegen, um ihre Wächterfunktion auszuüben, war bisher nur unzureichend bekannt. Forscher des Freiburger Max-Planck-Instituts für Immunbiologie & Epigenetik konnten nun zeigen, dass die effektive Gewebeüberwachung auf einer Rezeptor-vermittelten Wanderbewegung beruht, bei der sich die Zellen mit Hilfe sogenannter Integrin-Proteine an ihrer Umgebung festhalten. Ohne funktionierende Rezeptoren waren Makrophagen in ihrer Bewegungsfähigkeit stark eingeschränkt und konnten kein effektives Überwachungsnetzwerk bilden, um Partikel und tote Zellen aufzunehmen.

Immunzellen bevölkern nahezu alle Organe, um unseren Körper zu schützen und dessen gesunden Zustand zu bewahren. Einige Immunzellen sitzen dabei während ihres gesamten Lebens in den Geweben und befinden sich in einem ständigen Überwachungsmodus. Bei schweren Gewebeverletzungen oder der Bekämpfung von Infektionen erhalten diese Zellen noch zusätzliche Unterstützung von Immunzellen, die aus dem Blutkreislauf in das Gewebe zu Hilfe eilen.
Das Labor von Tim Lämmermann am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg erforscht die zellulären Mechanismen, die diese Immunzellen steuern, wenn sie durch die komplexe Umgebung eines Gewebes manövrieren. In ihrer neuesten Studie ging das Labor der Frage nach, wie Makrophagen sich bewegen und ihre Überwachungsaktivitäten gemeinsam koordinieren, denn die Fresszellen bilden riesige Überwachungsnetzwerke im Gewebe.
Wache halten im Gewebe
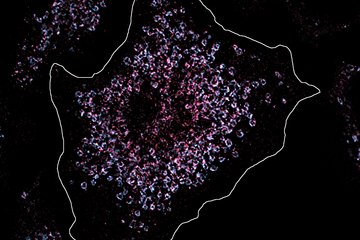
Makrophagen sind dafür bekannt jegliche Form von Zelltrümmern und Zellschrott zu verschlingen und zu verdauen. Sie fungieren demnach als Fresszellen, die absterbende Zellen im sich entwickelnden und bereits differenzierten Gewebe kontinuierlich entfernen. Wenn Erreger im Rahmen einer Infektion in unseren Körper eindringen, alarmieren Makrophagen das Immunsystem und rufen weitere Immunzellen zu Hilfe. Sie können aber auch selbst eingedrungene Mikroben und Fremdpartikel aufnehmen und beseitigen.
„Obwohl die verschiedenen Phasen der Fremdkörpererkennung, -aufnahme und -verdauung auf der Ebene einer einzelnen Zelle recht gut beschrieben sind, wissen wir eigentlich nur recht wenig darüber, wie Gruppen von Makrophagen diese Prozesse gemeinsam regulieren. Das ist überraschend, da seit Jahrzehnten bekannt ist, dass die Gewebeüberwachung eigentlich eine Teamleistung großer Zellpopulationen ist. Deshalb wollten wir herausfinden, wie sich einzelne Makrophagen in Geweben bewegen und welche Faktoren das dynamische Verhalten ganzer Makrophagen-Netzwerke beeinflussen. Ziel war es dabei Prozesse zu identifizieren, welche die Effizienz von Makrophagen-Netzwerken beim Aufspüren und Beseitigen von Partikeln und toten Zellen bestimmen“, sagt Tim Lämmermann.
Dafür untersuchte das Freiburger Forscherteam das Bewegungsverhalten von Makrophagen in speziellen 3D-Zellkulturen, die natürliches Gewebe imitieren, und auch in Mäusegeweben. Die Zusammensetzung und der Aufbau von Mausgewebe ist dem menschlichen Gewebe sehr ähnlich, weshalb die Wissenschaftler aus ihren Studien mit Mausgeweben auch viel über die Prozesse beim Menschen lernen können.
Bewegungsformen von Immunzellen
„Wenn wir davon sprechen, dass Makrophagen im Gewebe von Mäusen oder Menschen umherwandern, sollten wir uns nicht vorstellen, dass sie sich einfach ungehindert bewegen können. Vielmehr müssen sich die Zellen wirklich anstrengen und verschiedene Formen der Wanderung nutzen, um voranzukommen. Dabei müssen sie ihre Zellkörper zwischen den anderen Zelltypen eines Gewebes als auch durch die extrazelluläre Matrix quetschen. Diese Matrix ist ein dichtes Geflecht aus Makromolekülen wie Kollagenen und anderen Proteinen – also eher kein leicht zugängliches Gelände“, erklärt Neil Paterson, Erstautor der Studie.
Die meisten Immunzellen bevorzugen eine Bewegungsform, die der von Amöben ähnelt. Das bedeutet, dass sie ihren Vortrieb in erster Linie durch koordinierte Veränderungen ihrer Zellform erzeugen. Dazu fahren sie mit Hilfe des Zellskeletts Ausstülpungen aus und wieder ein. Auf diese Weise zwängen sich die Immunzellen durch das Gewebe, geleitet von Signalstoffen, die sie zum Ort einer Gewebeverletzung führen. „Zu unserer Überraschung fanden wir aber heraus, dass Makrophagen bei der Erkundung des Gewebes dieser von uns erwarteten Art der Immunzellwanderung nicht vollständig folgen. Stattdessen sind sie bei ihrer Fortbewegung auf starke adhäsive Wechselwirkungen mit der Gewebeumgebung angewiesen“, sagt Tim Lämmermann.
Makrophagen können Verlust von Integrin-Rezeptoren nicht ausgleichen
Bei dieser zweiten Art der Fortbewegung nutzen die Zellen sogenannte Integrin-Rezeptoren zur Kraftübertragung. So wandern Makrophagen vorwärts, indem sie an ihrer unmittelbaren Umgebung mittels dieser Adhäsionsrezeptoren ziehen. Die Ergebnisse des Lämmermann-Labors zeigen, dass diese Integrin-vermittelte Bewegung insbesondere für das Entfernen toter Zellen durch Makrophagen-Netzwerke entscheidend ist. Ohne funktionierende Rezeptoren kann das Makrophagen-Netzwerk Partikel kaum noch aufnehmen.
Damit wirft die Arbeit ein neues Licht auf den bisher weitgehend vernachlässigten Populationsaspekt der Gewebeüberwachung durch Makrophagen. Sie zeigt wie die Dynamik einzelner Zellen die Effektivität eines gesamten Makrophagen-Netzwerks bei der Beseitigung von toten Zellen im Gewebe beeinflusst. Zusammenfassend bieten die Ergebnisse der Freiburger Forscher um Tim Lämmermann neue Einsichten, wie Immunzellen zum Erhalt des gesunden Gewebes beitragen und die Entstehung von Entzündungen vermeiden.
TL/NP/MR