Visuelle Proteomik – auf dem Weg zu einem dreidimensionalen Proteinatlas
Damit Proteine ihre Funktionen in einer Zelle erfüllen können, müssen sie zur richtigen Zeit am richtigen Ort sein. Sie tun sich zudem häufig mit anderen zusammen und bilden Komplexe aus mehreren Dutzend Proteinen. Wolfgang Baumeister, Direktor am Max-Planck-Institut für Biochemie in Martinsried, und sein Team wollen herausfinden, wie die Proteine in einer Zelle verteilt sind und aus welchen Bauteilen die Proteinmaschinen bestehen. Dazu nehmen sie mit der von ihnen entwickelten Kryo-Elektronentomografie dreidimensionale Bilder von Zellen und ihren Proteinen auf.
Mehrere Tausend unterschiedlicher Proteine sind in einer Zelle am Werk. Damit das Zusammenspiel reibungslos funktioniert, muss jedes dieser Moleküle mit den passenden Partnern zusammenarbeiten. Mit der Kryo-Elektronentomografie (Kryo-ET) können Wolfgang Baumeister und seine Kollegen am Max-Planck-Institut für Biochemie die Proteine einer Zelle sichtbar machen und ihre räumliche Anordnung untersuchen.

Das Prinzip bei der Kryo-ET ist ähnlich dem der Computertomografie, mit der Ärzte den menschlichen Körper aus unterschiedlichen Richtungen mit Röntgenstrahlen durchleuchten: Das Objekt wird aus verschiedenen Blickwinkeln aufgenommen, und die zweidimensionalen Einzeldarstellungen werden anschließend von einer speziellen Software zu einem 3-D-Bild verrechnet.
Damit hat es sich aber auch schon mit den Gemeinsamkeiten. Denn die Kryo-ET arbeitet nicht mit Röntgen-, sondern mit Elektronenstrahlen. Und die Forscher beobachten mit ihrer Hilfe nicht menschliche Organe, sondern Moleküle in einer Zelle. Und damit sie diese nur wenige Millionstel Millimeter großen Objekte sichtbar machen können, brauchen sie ein so genanntes Transmissionselektronenmikroskop – also ein Mikroskop, bei dem nicht Licht, sondern Elektronen ein Objekt je nach Materialeigenschaft unterschiedlich gut durchdringen.
Mit dieser Technik wollen die Wissenschaftler um Wolfgang Baumeister alle größeren Proteine einer Zelle sichtbar machen und so einen Atlas vom Protein-Inventar einer Zelle erstellen. Mit diesem Wissen könnten die Forscher beispielsweise vorhersagen, wie verschiedene Zelltypen auf bestimmte Signale oder Umwelteinflüsse reagieren.
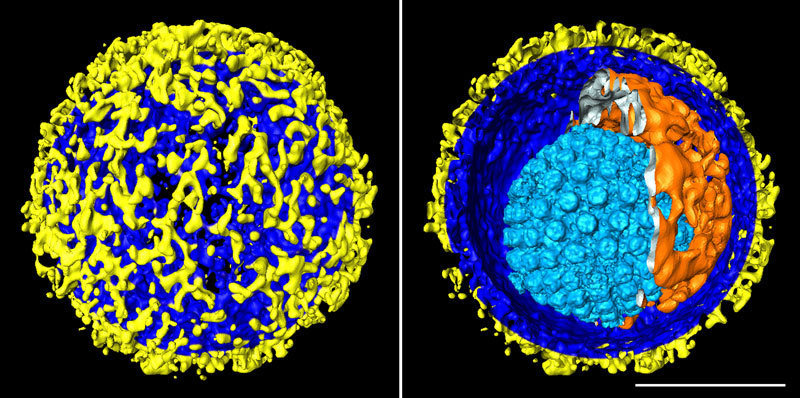
Den Max-Planck-Forschern ist mit der Kryo-ET bereits eine Reihe faszinierender Schnappschüsse gelungen. So haben sie etwa 3-D-Bilder des Herpes-simplex-Virus erstellt und den Aufbau des kompletten Virus einschließlich seiner Hüllschichten dreidimensional dargestellt. Die Aufnahmen zeigen, wie eine Proteinhülle mit ikosaedrischer Symmetrie – das so genannte Kapsid – das Erbgut des Virus umschließt. Das Kapsid wiederum ist vom Tegument umgeben, das schließlich von der Hüllmembran eingeschlossen wird. Aus der Hüllmembran ragen Hunderte Protein-Fortsätze in unterschiedlicher Form und Größe, die es dem Virus ermöglichen, Körperzellen zu infizieren.

3D-Rekonstruktionen der Synapsen von Nervenzellen zeigen, wie die kleinen Vesikelbläschen, die den Botenstoff für die Übertragung von Signalen enthalten, durch fadenförmige Proteine an Ort und Stelle gehalten werden. Die Proteinfäden verbinden die Vesikel untereinander und halten sie so lange in der aktiven Zone der Synapse, bis sie das Signal erhalten, mit der Zellmembran zu verschmelzen und ihren Inhalt nach außen abzugeben.
Außerdem haben die Wissenschaftler die Poren des Zellkerns untersucht, also den Proteinkomplexen, durch die Moleküle in den Zellkern oder aus ihm heraus transportiert werden. Die Auflösung der Bilder ist so hoch, dass auf ihnen sogar die Moleküle zu sehen sind, die gerade in den Zellkern geschleust werden.
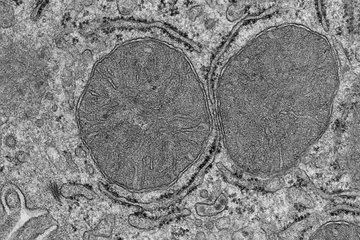
Auch die Proteinfabriken der Zelle, die Ribosomen, enthüllen dank der Kryo-ET ihren dreidimensionalen Aufbau und ihre Funktionsweise. So haben die Forscher herausgefunden, nach welchem Muster sich die Ribosomen zusammenlagern, damit sie die Boten-RNA, also die Montageanleitung, auslesen und die Proteine produzieren können. Dabei orientieren sie sich so, dass die gebildeten Proteine genügend Platz haben, um sich korrekt zu falten. Darüber hinaus haben die Wissenschaftler mithilfe der Kryo-ET die besondere Anordnung von Bakterien-Ribosomen festgehalten, wenn diese nicht in Betrieb sind. Die Bilder zeigen, dass sich die Ribosomen paarweise aneinanderlagern, sobald die Bakterien keine Nahrung finden. In dieser Warteposition überdauern sie die Zeit, bis genügend Nahrung vorhanden ist, um die Proteinproduktion wieder aufzunehmen.

Nach den an sich schon winzigen Viren, synaptischen Vesikeln und anderen Zellorganellen wollen die Wissenschaftler nun also noch kleinere Objekte ablichten: einzelne Proteinmoleküle. Diese können beispielsweise für die Medizin wertvolle Erkenntnisse parat halten. Denn Felix Bäuerlein, Doktorand in der Arbeitsgruppe von Wolfgang Baumeister, möchte damit Nervenzellen von Alzheimer-Patienten untersuchen. Bei dieser Demenzerkrankung verklumpen manche Proteine und bilden Ablagerungen in den Zellen. „Wenn wir den Aufbau dieser Proteinplaques kennen, wissen wir vielleicht auch, warum sie für die Zellen so schädlich sind “, hofft der Forscher.
Um Proteine möglichst naturgetreu abbilden zu können, müssen die Forscher die Proben zunächst in ihrem ursprünglichen Zustand „festhalten“. Dazu verzichten sie auf Chemikalien, da sie die Struktur der Proteine verändern würden. Stattdessen setzen sie auf Schockfrosten: Blitzschnell schießen sie die Probe mit einer Guillotine-ähnlichen Vorrichtung in ein Ethan-Bad, das von minus 196 Grad kaltem flüssigem Stickstoff umgeben ist. Beim Eintauchen erstarrt die Probe innerhalb weniger tausendstel Sekunden. Durch das schlagartige Abkühlen hat das Wasser keine Zeit auszukristallisieren. Vielmehr bildet sich um die Probe herum eine Schicht aus so genanntem amorphen Eis. Dabei sind die Wassermoleküle nicht regelmäßig wie in einem Kristall, sondern zufällig angeordnet. Das ist entscheidend, denn Eiskristalle würden die Strukturen in der Zelle verändern oder sogar zerstören.
Das Elektronenmikroskop, mit dem die Wissenschaftler die Proben anschließend analysieren, gehört zu den modernsten weltweit. Mit einer Höhe von mehreren Metern reicht das Ungetüm fast bis zur Decke eines schaumstoffverkleideten Raums im Keller des Instituts. Der Schaumstoff soll während des Betriebs jegliche Erschütterung dämpfen, denn schon Schritte auf dem Gang oder das Schlagen einer Tür würden die Aufnahmen verzerren. Insgesamt vier solcher Mikroskope stehen im Martinsrieder Max-Planck-Institut.
Damit die schockgefrosteten Untersuchungsobjekte nicht auftauen, werden sie auch im Mikroskop permanent durch flüssigen Stickstoff gekühlt. Denn die Proben dürfen sich nicht auf mehr als minus 136 Grad erwärmen, ansonsten bilden sich die zerstörerischen Eiskristalle. Im Mikroskop liegt die Probe auf einer kippbaren Halterung. So können die Wissenschaftler ein Objekt um 140 Grad kippen und dabei etwa 150 Bilder aufnehmen. „Nach jedem Bild justiert sich das Mikroskop automatisch neu und stellt sich so wieder scharf. So gleicht es winzige Verschiebungen des Präparats zwischen zwei Aufnahmen aus“, erklärt Wolfgang Baumeister. Gemeinsam mit Kollegen hat er diese Methode zur automatischen Bilderzeugung Ende der 1980er Jahre entwickelt.

Nur dank dieser Automatisierung können Wissenschaftler solch umfangreiche Bilderserien anfertigen und dabei die Strahlungsdosis so gering halten, dass auch biologische Objekte nicht beschädigt werden. Ein bis zwei Stunden dauert es, bis eine ganze Serie fertig ist. Die anfallende Datenflut lässt sich nur mithilfe von ausgefeilter Software bewältigen. Komplizierte Computeralgorithmen suchen dann in den Aufnahmen nach Referenzpunkten, an denen sie die einzelnen Bilder ausrichten. Aus den aneinandergefügten Einzelbildern errechnet der Computer schließlich ein dreidimensionales Bild.
Am einfachsten lässt sich die Kryo-ET bei besonders dünnen Objekten einsetzen, beispielsweise Bakterienzellen. Denn der Elektronenstrahl kann nur Präparate bis zu einer Dicke von etwa 500 Millionstel Millimetern gut durchdringen – das entspricht etwa einem Hundertstel eines menschlichen Haars. Säugetierzellen sind jedoch deutlich dicker. Um auch Proteine in solchen Zellen untersuchen zu können, wenden die Max-Planck-Forscher ein Verfahren aus den Materialwissenschaften an: In einem so genannten Focused-Ion-Beam-Mikroskop beschießen sie die Oberfläche des Präparats mit einem energiereichen Strahl aus Gallium-Ionen. Man kann sich das wie einen Meteoriteneinschlag vorstellen, beim Aufprall schlagen die schweren Gallium-Teilchen die obersten Atome aus der Probe heraus. So wird Schicht für Schicht abgetragen, ohne dass die Zellen beim Schneiden gequetscht werden.
Wolfgang Baumeister und sein Team entwickeln ihre Methode ständig weiter. Inzwischen ist die Auflösung der dreidimensionalen Bilder so gut, dass darauf zwei Punkte unterscheidbar sind, die nur drei Millionstel Millimeter weit auseinanderliegen. Eine Schwierigkeit bei der Auswertung ist momentan noch, dass sich die interessanten Strukturen nur schwer vom Hintergrund abheben: Weil die Elektronendosis bei biologischen Präparaten sehr gering sein muss, sind die Bilder quasi unterbelichtet. Doch mittlerweile werden immer empfindlichere Detektoren entwickelt, die mit weniger Elektronen auskommen. „Damit könnten wir mit der gleichen Strahlungsmenge mehr Einzelbilder aufnehmen“, sagt Wolfgang Baumeister. Je mehr Bilder die Forscher überlagern, desto präziser wird die Darstellung.