Forschungsbericht 2021 - Max-Planck-Institut für molekulare Biomedizin
Blutgefäßwachstum in künstlichen Geweben
Max-Planck-Institut für molekulare Biomedizin, Münster
Sind Gewebe in menschlichen Organen so stark beschädigt, dass die Organfunktion massiv eingeschränkt ist, ist eine Transplantation oft der einzige Ausweg. Da nur wenige Spenderorgane zur Verfügung stehen, werden dringend alternative Heilungsstrategien benötigt. Ein möglicher Ansatz bestünde darin, die beschädigten Geweberegionen durch Gerüststrukturen zu ersetzen, die von den Zellen des umliegenden gesunden Gewebes besiedelt werden, um so die natürliche Struktur wiederherzustellen. Hierfür könnten sich künstliche Materialien besonders gut eignen, da sie anders als natürliche Gewebekomponenten lange genug stabil im Körper bleiben, um diesen Besiedelungsprozess zu ermöglichen. Diese Strategie kann nur dann erfolgreich sein, wenn die verwendeten Materialien nicht nur die Funktion der gewebespezifischen Zelltypen unterstützen, sondern auch das Wachstum von Blutgefäßen ausgehend vom umliegenden gesunden Gewebe ermöglichen – ein Prozess, der Angiogenese genannt wird. Dies ist eine unerlässliche Voraussetzung für die Versorgung des Gewebes mit Nährstoffen und Sauerstoff, und damit schlussendlich für dessen Funktion. Hier stehen wir vor einer der größten Fragen der modernen Medizin: wie müssen Materialien beschaffen sein, damit sie das Blutgefäßwachstum unterstützen können?
Synthetisches Hydrogel als dreidimensionales Gewebegerüst
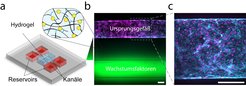
Um diese Wissenslücke zu schließen und den Einfluss von Materialeigenschaften auf das Blutgefäßwachstum untersuchen zu können, entwickelten wir das erste Zellkulturmodell, das die wichtigsten Prozesse der natürlichen Angiogenese innerhalb eines künstlichen Materialsystems nachbildet [1, 2]. Als Herzstück des Modells synthetisierten wir ein zuckerbasiertes Hydrogel, dessen Eigenschaften kontrolliert und unabhängig voneinander verändert werden können [3]. Die Zellen können durch diese dreidimensionale Umgebung wandern, indem sie das Zuckerrückgrat enzymatisch abbauen. Um auch die strukturellen Eigenschaften der röhrenförmigen Blutgefäße nachbilden zu können, erzeugten wir zwei Kanäle innerhalb des Hydrogels. Einen dieser Kanäle besiedelten wir mit Endothelzellen, die die natürlichen Blutgefäße auskleiden, um so das Ursprungsgefäß im gesunden Gewebe nachzuahmen. Durch den zweiten Kanal schickten wir einen Cocktail aus den Wachstumsfaktoren, die in nativen Geweben das Blutgefäßwachstum vorantreiben. Diese bildeten einen Gradienten in Richtung der Endothelzellen, der dazu führte, dass die Zellen in das umgebende Hydrogel einwanderten – ein Prozess, der auch Sprossung genannt wird.
Platzmangel schränkt das Blutgefäßwachstum ein
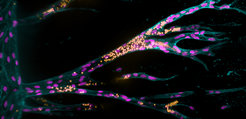
Im nächsten Schritt wollten wir herausfinden, wie die Eigenschaften des Hydrogels die Endothelzell-Sprossung beeinflussen. Hierbei fokussierten wir uns zunächst auf den Einfluss von sogenannten Adhäsionsliganden, über die sich die Endothelzellen im Gewebe anheften und die wichtige Signale für deren Funktion beinhalten. Je höher die Konzentration der Liganden war, desto mehr Endothelzellen wanderten als zusammenhängende Stränge durch das Hydrogel. Diese kollektive Migration war wiederum die Voraussetzung dafür, dass die Zellen im folgenden Schritt Hohlräume bilden konnten, die mit dem Ursprungsgefäß verbunden waren. Die auf diese Weise gebildeten Gefäßstrukturen waren allerdings zunächst kleiner als in natürlichen Geweben. Wir stellten die Hypothese auf, dass dieser Unterschied mit der reduzierten Abbaubarkeit unserer Hydrogele im Vergleich zu natürlichen Gewebegerüsten erklärt werden kann. Um dieses Problem zu umgehen, modifizierten wir das Hydrogel derart, dass es durch die Zellen leichter enzymatisch gespalten werden kann. Durch diese Optimierung haben wir es zum ersten Mal geschafft, Gefäßstrukturen in künstlichen Materialien wachsen zu lassen. In abschließenden Experimenten konnten wir zeigen, dass diese nicht nur ähnlich groß wie natürliche Blutgefäße waren, sondern auch viele funktionelle Eigenschaften widerspiegelten.
In zukünftigen Experimenten werden wir unser Modell erweitern, z. B. durch das Einbringen weiterer biochemischer Moleküle, die wichtige Signale an die Endothelzellen weitergeben. Unser Fernziel ist es, den Prozess der natürlichen Angiogenese bestmöglich in Zellkultur nachzubilden, um so ein volles Verständnis der Parameter zu erhalten, die für das erfolgreiche Blutgefäßwachstum erforderlich sind.