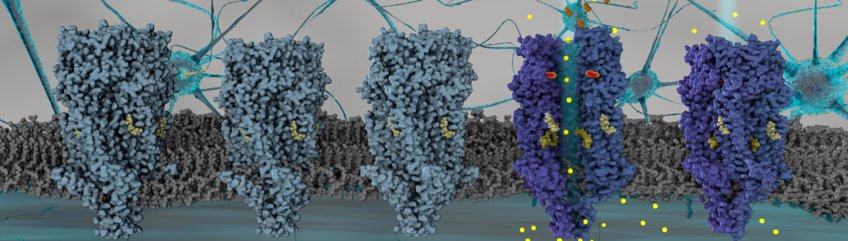
Struktur des Serotoninrezeptors
Forschende klären strukturelle Details des Serotonin-Rezeptors in Lipid-Umgebung auf
Wieder ist man der Aufklärung der Interaktion des Neurotransmitters - oft als "Glückshormon" bezeichnetem Serotonin an einen seiner Rezeptoren, einen Schritt näher gekommen. Einem internationalen Forscherteam ist es gelungen, die Struktur des Serotonin-Rezeptors 5-HT3AR direkt in der Lipidschicht genauer aufzuklären. Serotonin bindet außerhalb der Zelle an diesen Rezeptor, wobei dies zu einer Öffnung einer spezifischen Ionenpore im Membranteil des Rezeptors führt.

Der 5-HT3A-Rezeptor (5-HT3AR) ist ein pentamerer, Liganden-gesteuerter Ionenkanal (pLGIC), der eine schnelle Neurotransmission im Gehirn reguliert. Wenn Kationen durch den inneren Kanal des Rezeptors wandern, kommt es zu einer physiologischen Folgereaktion. Jahrzehntelange Studien haben die Funktion der Lipide bei der Modulation der pLGIC aufgezeigt, jedoch sind die Details des molekularen Mechanismus noch nicht vollständig geklärt. 5-HT3AR stellt einen interessanten Fall dar, da trotz bekannter Strukturen in Detergentien sowohl in Anwesenheit als auch in Abwesenheit seines Agonisten Serotonin berichtet worden ist. Aber der Mechanismus der 5-HT3AR-Tor-Steuerung bleibt eine offene Frage, zum Teil weil die eindeutige Struktur des Rezeptors im offenen Zustand fehlt. Tatsache ist, dass Detergenzien, die typischerweise für die Aufreinigung von Membranproteinen verwendet werden, die funktionell wichtigen Lipide entfernen, die die Konformation und damit die Funktion der Proteine beeinflussen können.
In der veröffentlichten Arbeit klären Yingyi Zhang und Patricia Dijkman vom Max-Planck-Institut für Biophysik und weitere Kolleginnen und Kollegen diesen Mangel am Verständnis der Funktionsweise der Lipidregulation des Rezeptors auf, indem sie eine strukturelle Grundlage für die Modulation der 5-HT3AR-Konformation und des Gatings durch die Lipidumgebung gefunden haben. Das Forscherteam löste die Struktur des Rezeptors in Lipid-Doppelschicht-Nanopartikeln in Ab- und Anwesenheit von Serotonin mittels Kryo-Elektronenmikroskopie.
In Zusammenarbeit mit der Gruppe von Shuguang Yuan von der Chinesischen Akademie der Wissenschaften, Shenzhen, China, konnten die Forscherinnen und Forscher mit Hilfe von Molekulardynamik-Simulationen zeigen, dass die in Lipide eingebettete Rezeptorstruktur in der Serotonin-gebundenen Form einen geöffneten Kanal bildet. Dieser Kanal ermöglicht die freie Diffusion von Natrium-Ionen über die Membranregion. Diese Agonisten-gebundene Struktur in einer Lipid-Doppelschicht zeigt eine viel größere Porenöffnung als alle zuvor beobachteten Strukturen in Detergentien.
Strukturelle Details des Serotonin-Rezeptors
Darüber hinaus zeigen diese in Lipide eingebetteten Strukturen des Rezetors wesentliche Unterschiede im Vergleich zu Detergenz-basierten Strukturen und lklären das Rezeptor-Gating. Misha Kudryashev vom Max-Planck-Institut für Biophysik betont die Bedeutung dieser Beobachtung: "In der Lipid-Doppelschicht zeigen die äußeren Transmembranhelices eine Verschiebung von mehr als 10 Å im Vergleich zu ihrer Position in Detergenz. Wir sind nun in der Lage, einen Mechanismus aufzuklären, wie die Membranumgebung die Struktur und Funktion von 5-HT3AR beeinflußt. Aufgrund der hoch konservierten Aminosäureresten verwandter Rezeptoren, die bei diesem angenommenenden Mechanismus der Lipidmodulation involviert sind, glauben wir, dass unsere Ergebnisse auf andere pLGICs verallgemeinert werden können." 5-HT3AR ist von hoher pharmazeutischer Relevanz als Wirkstoffziel für die Behandlung von z.B. Erbrechen und Reizdarmerkrankungen.