Epigenetische Veränderungen sind selten von Dauer
Erste umfassende Kartierung von epigenetischen Veränderungen über mehrere Generationen zeigt, dass diese oft kurzlebig sind und daher wahrscheinlich nur selten die Evolution beeinflussen
Jean-Baptiste Lamarck hätte seine Freude: Seine Überzeugung, dass Lebewesen erworbene Eigenschaften an ihre Nachkommen weitergeben können, ist seit kurzem unter Genetikern wieder gesellschaftsfähig. Die Transformationslehre, die Lamarck vor rund 200 Jahren veröffentlichte, ruhte seit dem Siegeszug von Darwins Evolutionstheorie in der Mottenkiste der Geschichte. Seit einigen Jahren weiß man jedoch, dass Umwelteinflüsse durchaus ihre Spuren im Erbgut hinterlassen können – in Form so genannter epigenetischer Veränderungen. Die erste umfassende Bestandsaufnahme spontan auftretender Unterschiede legen nun Wissenschaftler des Max-Planck-Instituts für Entwicklungsbiologie in Tübingen vor. Am Beispiel der Ackerschmalwand Arabidopsis thaliana bestimmten sie, wie häufig und in welchen Bereichen des Genoms epigenetische Modifikationen auftreten - und wie schnell sie wieder verschwinden. Demnach sind epigenetische Veränderungen zwar um Größenordnungen häufiger als die klassischen Mutationen, aber dafür oft kurzlebig. Sie spielen damit möglicherweise für die Evolution eine geringere Rolle als bislang angenommen.
Das Team um Detlef Weigel, Direktor der Abteilung für Molekularbiologie, konzentrierte sich auf eines der wichtigsten epigenetischen Merkmale, die Methylierung der DNA. Dabei werden winzige chemische Bausteine –Methylgruppen – an einzelne Buchstaben der DNA angeheftet, meist an ein Cytosin. Die eigentliche Erbinformation, die Buchstabenfolge der DNA, bleibt dabei allerdings unangetastet. Um die Häufigkeit von Methylierungsänderungen und deren Verteilung im Genom zu untersuchen, untersuchten die Tübinger Biologen zehn Linien der Ackerschmalwand Arabidopsis thaliana, die alle von demselben direkten Vorfahren abstammten und über 30 Generationen hinweg per Selbstbefruchtung gezogen worden waren. Im Genom der letzten Generation suchten die Wissenschaftler dann nach Unterschieden im Methylierungsmuster, die sich im Vergleich zur Ausgangspflanze ergeben hatten. Dabei erstellten sie für jedes Individuum eine Karte aller Methylierungen im kompletten Genom – des so genannten Methyloms.
„Wir haben pro Pflanze rund 14 Millionen Cytosine analysieren können“, veranschaulicht Claude Becker, wissenschaftlicher Mitarbeiter am Max-Planck-Institut und federführend bei der Studie, den enormen Aufwand. Im Durchschnitt konnten in jeder Linie Methylgruppen an fast 3 Millionen Cytosinen nachgewiesen werden. Zwar war der weitaus größte Teil dieser methylierten Cytosine in allen Pflanzen gleich, aber bei etwa 6 Prozent stießen die Forscher auf Unterschiede: Hier hatte in mindestens einer der Linien eine Veränderung stattgefunden – entweder die Anheftung oder die Abspaltung einer Methylgruppe. Jede Linie wies etwa 30.000 solcher Epimutationen auf. Zum Vergleich: In derselben Zeit hatten sich in keiner Linie mehr als 30 Mutationen in der DNA-Sequenz angehäuft.
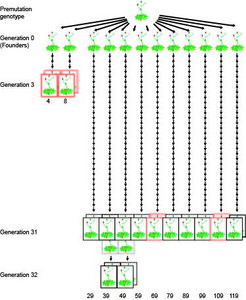
Mit 30.000 Epimutationen, die nach 30 Generationen gefunden wurden, hätten die Genetiker daher etwa 1.000 Epimutationen pro Generation erwartet. Ein Vergleich von Eltern und deren direkten Nachkommen ergab jedoch eine drei- bis viermal höhere Epimutationsrate. Offenbar kehrt die DNA-Methylierung nach einigen Generationen häufig wieder zum Ausgangszustand zurück. Das Mitteln der Mutationsrate über mehrere Generationen ergibt daher ein falsches Bild. Beckers Kollege Jörg Hagmann warnt deshalb auch davor, die Bedeutung der DNA-Methylierung für die Evolution zu überschätzen: „Unsere Experimente zeigen, dass veränderte Methylierung Hand in Hand mit einer hohen Reversionsrate einhergeht.“ Mit anderen Worten: Die Unterschiede bleiben nicht unbedingt über viele Generationen hinweg erhalten, sondern können ebenso gut wieder zurückmutieren. „Erst wenn die Selektion über die Reversion siegt, ist die Veränderung auch evolutionär wirksam“, so der Tübinger Biologe. Eine neue Methylierung muss also einen deutlichen Anpassungsvorteil mit sich bringen, damit sie sich durchsetzen kann, bevor sie wieder verloren geht. Da Rückwärtsmutationen jedoch nicht unbedingt gleich in der nächsten Generation auftreten, können epigenetische Unterschiede dennoch zur kurzfristigen Vererbung von Merkmalen zwischen Eltern und Kindern oder Großeltern und Enkeln beitragen.
Ein weiterer Unterschied zu gewöhnlichen Mutationen ist außerdem, dass Epimutationen nicht zufällig auftreten, sondern oft an denselben Stellen im Genom. Während Gene überdurchschnittlich oft von Veränderungen in der Methylierung betroffen waren, ist die Methylierung von mobilen DNA Elementen, den Transposons, sehr stabil. Dies ergibt durchaus Sinn, da bereits bekannt war, dass ein künstlich induzierter Verlust der Methylierung sich viel stärker auf die Aktivität von Transposons als von normalen Genen auswirkt.

Größere Bedeutung als der Zustand einzelner Cytosine hat wohl die Methylierung größerer Erbgutabschnitte. „Wir haben insgesamt in jeder Pflanze nur etwa 30 Bereiche des Genoms identifiziert, in denen Unterschiede in der DNA-Methylierung gebündelt auftraten“, erläutert Becker. „Die epigenetische Veränderung ganzer Regionen scheint genauso selten vorzukommen wie echte Sequenzmutationen“, folgert Hagmann. Allerdings könnten sich ganze Regionen ebenfalls sehr schnell ändern. So haben die Wissenschaftler sogar einen Abschnitt finden können, der seine Methylgruppen erst verloren hatte, aber in der nächsten Generation vollkommen remethyliert worden war.
Was die Epigenetik für die Medizin interessant macht, ist die Tatsache, dass manche epigenetischen Veränderungen von äußeren Faktoren ausgelöst werden können. Beim Menschen etwa wird angenommen, dass Einflüsse wie Ernährung oder die Eltern-Kind-Bindung Spuren im Erbgut hinterlassen, die sogar an die Nachkommen weitergegeben werden und deren Gesundheit beeinflussen. Die begrenzte Stabilität der DNA-Methylierung führt dazu, dass solche Unterschiede jedoch nicht unbedingt auf lange Zeit beibehalten werden und daher nur in Einzelfällen der natürlichen Selektion unterworfen werden können.
Wie die Tübinger Versuche belegen, finden epigenetische Veränderungen in erheblichem Umfang spontan, also ohne besondere Einflüsse aus der Umwelt statt – die Wachstumsbedingungen im Gewächshaus waren für alle Pflanzenlinien gleich. Das lässt Raum für weitere Spekulationen, wie Becker feststellt: „In freier Natur, wo die Pflanzen dauernd den unterschiedlichsten Stressfaktoren ausgesetzt sind, dürfte die Zahl der Epimutationen deutlich höher liegen.“ Wenn dies auch mit einer höheren Rückmutationsrate einhergeht, wäre die Bedeutung der Epigenetik für die langfristige Evolution noch geringer, als die Tübinger Biologen vermuten.
B/HR


