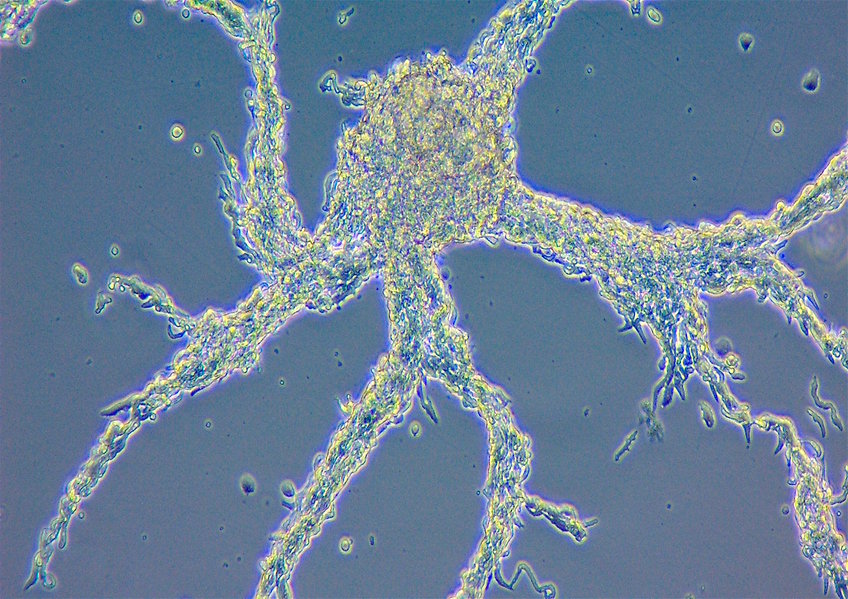
Mangel an Schwefel lässt Schleimpilze zu Vielzellern werden
Schwefelstoffwechsel ebnete den Weg für die Vielzelligkeit
Wenn dem Schleimpilz Dictyostelium discoideum die Nahrung ausgeht, dann sorgt Schwefelmangel dafür, dass einzelne Zellen sich zu einem Vielzeller zusammenschließen. Forschende des Max-Planck-Instituts für Immunbiologie und Epigenetik in Freiburg haben herausgefunden, wie der Stoffwechsel eine entscheidende Rolle bei der Entstehung der Vielzelligkeit gespielt haben könnte. Darüber hinaus haben die Erkenntnisse aber auch therapeutische Implikationen für komplexere Organismen wie den Menschen. Die gezielte Beeinflussung des Schwefelstoffwechsels in Krebszellen könnte die Anti-Tumor-Immunität verbessern.

Der Übergang von Einzellern zu Vielzellern war ein wichtiger Schritt in der Evolution komplexer Lebensformen. Erste mehrzellige Organismen entstanden vor Hunderten von Millionen Jahren, aber wie und unter welchen Umständen, es zu diesem Ereignis kam, sind bis heute rätselhaft. Um die Ursprünge der Vielzelligkeit zu erforschen, wandte sich das Team von Erika Pearce am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg den Schleimpilzen zu, dem Modellorganismus Dictyostelium discoideum. Diese weltweit vorallem in allen Waldböden vorkommende Art kann sowohl in einem einzelligen als auch in einem mehrzelligen Zustand existieren und liegt damit an der Schwelle zu diesem entscheidenden Evolutionsschritt liegt. Entscheidend für diese dramatisch unterschiedlichen Zustände ist die Nahrung der Organismen.
Ein Schwerpunkt der Forschung von Erika Pearces Labor ist der Zellstoffwechsel und wie dessen Veränderungen die Zellfunktion und Differenzierung der Zellen antreiben. Normalerweise untersuchen die Forschenden Zellen des Immunsystems wie etwa Makrophagen oder T-Zellen, um diese Frage zu beantworten. Aber als Postdoktorandin Beth Kelly zur Gruppe stieß, beschlossen sie, den Fokus zu verlagern. „Da wir verstehen wollen, wie die Verfügbarkeit von Nährstoffen Veränderungen der Funktionsweisen in den Zellen hervorruft, gibt es kaum einen besseren Organismus als den Schleimpilz, in dem das Aushungern von Zellen dazu führt, dass sie nicht mehr allein existieren, sondern einen vielzelligen Organismus bilden. Das ist eine immense Veränderung in der Biologie”, sagt Erika Pearce.
Hunger treibt die Verbandsbildung dieser sozialen Amöbe an
Entziehen die Forscherinnen im Labor den einzelligen Amöben die Nahrungszufuhr, können sie diese in ein vielzelligen Verband verwandeln. Auf diese Weise ist es dem Team möglich, die Faktoren zu untersuchen, die diese Vielzelligkeit antreiben. Der Verband verhält sich wie ein komplexer, multizellulärer Organismus, bei dem sich einzelne Zellen auf unterschiedliche Funktionen spezialisieren. Schließlich bildet der vielzellige D. discoideum einen langen Stiel, der eine Kugel mit schützenden Sporen trägt. Dies ermöglicht es der Population auch bei Nahrungsmangel zu überleben.
In hungernden Schleimpilzen zeigt sich ein schneller Anstieg von Sauerstoffradikalen. Sauerstoffradikale sind kleine Moleküle, die von unseren Zellen als Nebenprodukt während der Energiegewinnung gebildet werden. Sie dienten aber aber auch schon früh in der Evolution für die Signalübertragung, bevor komplexere, rezeptorbasierte Systeme existierten. Wenn ihre Werte jedoch zu hoch sind, werden sie schädlich. Sie oxidieren Proteine und Nukleinsäuren und führen schließlich zum Absterben der Zellen. Daher wird ein Anstieg der Sauerstoffradikalen im Allgemeinen von der Produktion von Antioxidantien begleitet, um die Konzentration zu kontrollieren. „In unserem Fall stieg die Produktion des Antioxidans Glutathion an, um dem massiven Anstieg der Sauerstoffradikalem beim Verhungern entgegenzuwirken. Wenn wir dem hungernden Schleimpilz zusätzliches Glutathion gaben, konnten wir diesen Anstieg der Sauerstoffradikale blockieren und, noch wichtiger, die Bildung des mehrzelligen Verbande stoppen und die Zellen in einem einzelligen Zustand halten“, erläuter Beth Kelly, Erstautorin der Studie.
Hungernde Schleimpilze verändern ihren Stoffwechsel
Als sie wiederum die Glutathion-Produktion mit einem Hemmstoff blockierten, stellten sie fest, dass dies die Verbandsbildung nicht weiter beschleunigte, sondern umkehrte und der einzellige Zustand länger erhalten blieb. Dies ließ die Forschenden vermuten, dass irgendeine Funktion des beigefügten Glutathions, außer der antioxidativen Aktivität, den Verbandsbildungsprozess umkehren musste. Sie betrachteten, wie Glutathion hergestellt wird. Es besteht aus nur drei Aminosäuren, Cystein, Glycin und Glutamin. Als das Team jede dieser Komponenten einzeln hungernden Zellen hinzufügte, zeigt sich, dass allein Cystein die multizelluläre Aggregation nach dem Verhungern umkehren konnte.
Doch was ist das Besondere an Cystein? Es ist eine von nur zwei Aminosäuren, die Schwefel enthält. Dieser Schwefel ist entscheidend für eine Vielzahl von Prozessen in sich vermehrenden Zellen. Es wird für die Bildung neuer Proteine verwendet, ist für die Aktivität von Enzymen unerlässlich und unterstützt Stoffwechselprozesse zur Energiegewinnung. Eine Verknappung von Cystein schränkt daher die Schwefelversorgung ein, verlangsamt das Wachstum und die Zellteilung und zeigt so auch der Zelle an, dass nicht genügend Nährstoffe vorhanden sind, um diese Prozesse fortzusetzen. Für D. discoideum bedeutet dies, dass in einen mehrzelligen Zustand übergegangen werden sollte, um eine Spore zu bilden. So kann die Zeit der Nährstoffknappheit überstanden und die Population am Leben erhalten werden.
Schwefel bestimmt Zellfunktion und Vielzelligkeit
Die Daten der Freiburger Forscher und Forscherinnen zeigen: es ist eigentlich der Mangel an Schwefel, der der Vielzelligkeit zugrundeliegt, und die Erhöhung der Sauerstoffradikalen eher ein geschicktes Mittel für den Schleimpilz, diesen Prozess zu erreichen. Denn durch die Erhöhung der Sauerstoffradikalen erhöht das hungernde Dictyostelium die Produktion des Antioxidans Glutathion. „Dies führt dazu, dass mehr Cystein in den Zellen in Glutathion umgewandelt wird, wodurch die Verwendung des Schwefels für die Proliferation und Proteinproduktion eingeschränkt wird“, erläutert Beth Kelly. Indem die Forschenden in ihren Experimenten die Glutathion-Produktion künstlich blockierten oder den hungernden Zellen zusätzliches Cystein zuführten, konnten sie diese Schwefelversorgung wiederherstellen und somit die Proliferation und den einzelligen Zustand wiederherstellen. „Es ist also der Schwefel, ein recht häufig vorkommendes Element in der alten Welt, der dem Schleimpilz einen Wechsel zwischen dem einzelligen und dem mehrzelligen Zustand ermöglicht“, so Beth Kelly.
„Darüber hinaus denken wir, dass unsere Arbeit zukünftig auch therapeutische Relevanz für komplexere Organismen hat. Krebszellen sind hoch proliferativ, und einige Krebszellen besitzen einen sehr spezifischen Schwefelstoffwechsel. Die gezielte Beeinflussung der Stoffwechselprozesse in diesen Zellen könnte die Anti-Tumor-Immunität verbessern“, so Erika Pearce. So bewegen sich Immunzellen durch verschiedenste Umgebungen, die auch unterschiedliche Nährstoffmischungen enthalten, und die Funktion der Immunzellen hängt von der Aktivität der Stoffwechselwege ab. Die Beeinflussung des Schwefelstoffwechsels könnte ein Mittel sein, auch die Funktion der Immunzellen zu modulieren.
BK/MR