Erdbeben in der Zelle
Wissenschaftler entdecken, wie eine Modifikation der Kernlamelle die Kernform erhält
Das Erbgut wird sicher im Zellkern einer jeden Zelle verwahrt. Dieser ist umgeben von einem dichten Verbund von Proteinen, der ihm zugleich seine charakteristische runde Form verleiht. Anomalien der Kernform wie etwa sich abspaltende Mikrozellkerne oder aus dem Hauptkern herausragende Kernbläschen haben verheerende Folgen für das Erbgut. So werden Mikrozellkerne bei spezifischen Krebsarten beobachtet und indizieren eine schlechtere Prognose. Wissenschaftler vom Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg haben nun gezeigt, dass das epigenetische Enzym MOF für die morphologische Integrität Zellkerns von Säugetieren entscheidend ist. Fehlt es, kommt es zur verstärkten Ausprägung von Kernanomalien. Darüber hinaus haben die Forscher einen bisher unbekannten epigenetischen Mechanismus entdeckt, der Zellen vor zusätzlichen Schäden zu schützen scheint.
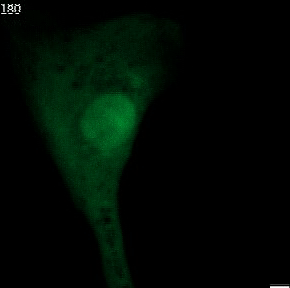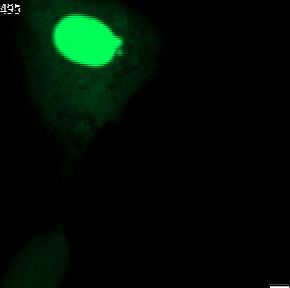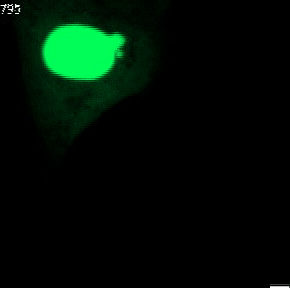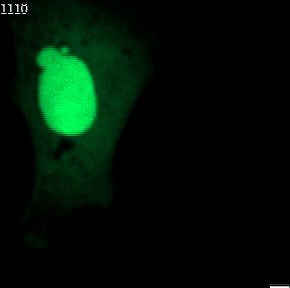
Nahezu jede Säugetierzelle enthält einen Zellkern. Dieser schützt das Erbgut im Inneren. Bei gesunden Organismen erhält der meist rundlich geformte Kern seine Stabilität durch die Kernhülle und die Kernlamelle. Letzteres ist eine Geflecht von Proteinen an der Innenseite der Kernhülle, das dem Kern auch seine charakteristische rundliche Form verleiht.
Bei menschlichen Erkrankungen wie etwa Krebs werden häufig Anomalien der Kernform beobachtet. Insbesondere sogenannte Mikronuklei (kleine zusätzliche Zellkerne in der Nähe des Hauptkerns) und Kernbläschen (extreme Auswölbungen des Hauptkerns). Es ist bekannt, dass diese Anomalien schwerwiegende Auswirkungen auf die Integrität des Erbguts haben und deswegen auch seit langem eine Bedeutung für die Krebsdiagnose und -prognose besitzen. Die genauen molekularen Mechanismen der Entstehung von Mikrozellkernen und Kernbläschen sind bis heute nicht vollständig verstanden.
Ohne MOF Verlust der Kernform
In ihrer neuesten Studie entdeckte das Labor von Max-Planck-Direktorin Asifa Akhtar eine Häufung von Mikrozellkernen und Kernbläschen in Primärzellen nach dem Verlust des epigenetischen Regulationsenzyms MOF. Dieses gut charakterisierte Enzym erleichtert die Zugänglichkeit zum genetischem Material. Es modifiziert die sogenannten Histone, also Proteinkugeln, um die sich die DNA wickelt, um in den Zellkern hineinzupassen. „MOF lagert Acetylgruppen auf den Histonen an. Durch diese Acetylierung öffnet sich das Chromatin, die Verpackung der DNA, und ermöglicht die Genaktivität und damit die Kodierung von Proteinen. Wir haben uns in dieser Studie gefragt, was der Zusammenhang zwischen dem klassischen epigenetischen Regulator MOF und den Kernbläschen und Mikrokernen sein könnte“, erläutert Asifa Akhtar die zentrale Forschungsfrage.
Um Antworten zu finden, identifizierte ihr Team unter der Leitung des Doktoranden Adam Karoutas das gesamte Spektrum von Proteinen, die von MOF in der Zelle acetyliert werden. Ihre Analyse ergab, dass das Enzym nicht nur Histonproteine, sondern auch das Protein Lamin A/C ins Visier nimmt. Darüber hinaus gelang es dem Team den MOF-assoziierten NSL-Komplex zu identifizieren, der konkret für die Lamin A/C-Acetylierung verantwortlich ist. Lamin A/C ist einer der Bausteine der Kernlamelle, die als viskoelastische Hülle für den Kern dient. Die Studie zeigt, dass der Verlust der Lamin A/C-Acetylierung zu weicher werdenden Kernen führt, die anfälliger sind für mechanischen Druck und schließlich brechen können. Kernbläschen und Mikrozellkerne werden unter diesen Bedingungen mit viel größerer Wahrscheinlichkeit gebildet.
Zusammenbruch des Genoms im Zellkern
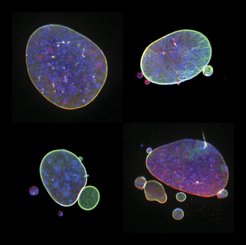
„Diese Kernbläschen und Mikrozellkerne stellen ein Risiko für die Unversehrtheit des genetischen Materials der Zelle dar. Als wir die DNA unserer Primärzellen ohne MOF sequenzierten, fanden wir einen Schlachtfeld vor,“ sagt Adam Karoutas, der Erstautor der Studie.
Was die Forscher sahen, waren die Überbleibsel einer zusammengebrochenen Zellkernarchitektur: ein Teil der Chromosomen war völlig zerfetzt, während andere gänzlich unversehrt blieben; Segmente einzelner Chromosomen waren an vielen Stellen gebrochen und falsch wieder zusammengesetzt; ganze Teile fehlten, während andere Chromosomensegmente in der falschen Ausrichtung dupliziert und neu in bestehende Chromosomen eingegliedert wurden. Wissenschaftler und Mediziner verwenden den Begriff „Chromothripsis“ (Chromo für Chromosom und Thripsis ist griechisch für Zerbrechen), um diese Zerstückelung des Erbguts zu beschreiben. „Solche fatalen Ereignisse finden sich bei zahlreichen Erbkrankheiten und treten in 20 bis 30 Prozent der hochaggressiven Krebsarten auf. Zum ersten Mal können wir jedoch Chromothripsis in Primärzellen beobachten, denen es nur an MOF mangelt“, sagt Adam Karoutas.
Der verzweifelte Versuch der Zelle mit ihren DNA-Reparaturmechanismen, die Fragmente wieder zusammenzusetzen und zu reparieren, führt angesichts der Vielzahl an Schäden zu Mutationen. Dadurch kann die Zelle schließlich die Kontrolle über den Zellzyklus verlieren – das Resultat können bösartige Tumore sein. Um die zugrundeliegenden molekularen Mechanismen dieser Phänomene zu verstehen, untersuchten die Forscher auch verschiedene epigenetische Parameter der Zellkernanomalien. Zu ihrer Überraschung fanden sie heraus, dass sich Kernbläschen und Mikrozellkerne von ihren benachbarten Hauptkernen darin völlig unterscheiden.
Epigenetischer Mechanismus zur Schadensbegrenzung
„Während die Hauptkerne ein ausgewogenes Verhältnis von Regionen mit "lose" und "dicht" DNA aufweisen, die als Euchromatin bzw. Heterochromatin bezeichnet werden, beobachten wir, dass DNA in den Mikrokernen und Kernbläschen hauptsächlich im heterochromatinen Zustand vorliegt. Diese enger und dichter gepackte Form der DNA unterdrückt die Genaktivität“, sagt Adam Karoutas.
Die Freiburger Wissenschaftler bezeichnen dieses neu beobachtete Phänomen als "Heterochromatin Enrichment in Nuclear Abnormalities" (HENA). Genau wie Henna-Tattoos (engl. Hena) die Hände mit schmuckvollen Verzierungen bedecken, bedecken Histonmodifikationen die DNA im Falle derartiger Zellkernanomalien. „Auffallend ist, dass HENA einen Einfluss auf die Transkription der Gene zu haben scheint, also den Prozess, bei dem ausgehend von der DNA-Vorlage RNA hergestellt wird. So werden Gene einfach abgeschaltet, die in Zellkernanomalien "gefangen" sind und möglicherweise beschädigt wurden. Wir denken, dass HENA eine schützende Rolle in Zellen spielen kann; besonders da, wo sich Zellkernanomalien häufen und dies krebserregend wirken könnte“, erklärt Asifa Akhtar.
Wege, die Katastrophe zu verhindern
Das Team um Asifa Akhtar hofft, dass zukünftige Forschung die Rolle des epigenetischen Mechanismus HENA bei Krankheiten mit Kernanomalien wie Krebs besser erklären kann. Eine weitere vielversprechende Forschungsrichtung ist die pharmakologische Veränderung der Lamin A/C-Acetylierung mithilfe von Medikamenten. „Wir haben verschiedene Histondeacetylase-Inhibitoren getestet. Das sind epigenetische Medikamente, die bereits in der Krebstherapie eingesetzt werden. Sie bewirken eine Steigerung der Acetylierung bei allen Proteinen. In unseren ersten Versuchen mit Säugetierzellen beobachten wir einen Anstieg der Lamin A/C-Acetylierung, die Kernanomalien im Vergleich zu Zellen ohne MOF und ohne Behandlung verringerte“, sagt Adam Karoutas.
„Doch wie genau die von MOF ausgehende Acetylierung von Lamin A/C in lebenden Organismen reguliert wird, ist noch nicht ausreichend erforscht. Die vollständige Charakterisierung dieser Entdeckung in Mausmodellen, in verschiedenen Gewebearten oder auch während des Alterungsprozesses ist also der nächste logische Schritt für die Forschung. So kann hoffentlich das therapeutische Potenzial in der Zukunft erschlossen werden“, sagt Asifa Akhtar.