Emmanuelle Charpentier: die Künstlerin an der Gen-Schere
Im Flugzeug hatte sie die Idee ihres Leben - aber auch sonst ist die Wissenschaftlerin ständig in Bewegung
Manchmal kann eine einzige Entdeckung ein ganzes Leben verändern. Für Emmanuelle Charpentier war die Entschlüsselung der Funktionsweise eines bis dahin nur Experten bekannten Enzyms ein solcher Moment. Das als CRISPR-Cas9 bekannt gewordene Trio aus einem Enzym und zwei RNA-Molekülen hat weit über die Wissenschaft hinaus Furore gemacht. Seitdem ist im Leben der Französin vieles anders geworden. Anfang Oktober 2015 ist sie als Direktorin ans Berliner Max-Planck-Institut für Infektionsbiologie gekommen.

Es ist einer der letzten heißen Tage des Sommers 2015. Konzentriert sitzt Emmanuelle Charpentier in ihrem Büro in Braunschweig. Ihr Fuß wippt auf und ab. Die zierliche Französin ist wieder auf dem Sprung: Nach zwei Jahren am Helmholtz-Zentrum für Infektionsforschung zieht es sie in die deutsche Hauptstadt. In Berlin wird sie Direktorin am Max-Planck-Institut für Infektionsbiologie.
Ihr neues Institut steht auf historischem Grund in der Mitte der Stadt: auf dem Gelände der Charité. Hier begann Robert Koch Ende des 19. Jahrhunderts am Preußischen Institut für Infektionskrankheiten seinen Kampf gegen das Tuberkulose-Bakterium – ein passender Ort für eine Mikrobiologin, die zu den bedeutendsten Wissenschaftlerinnen unserer Zeit gehört.
Für Charpentier war es, nicht nur was die Temperaturen angeht, ein heißer Sommer. Sie wirkt ein bisschen angestrengt von dem Rummel, der seit zwei Jahren um sie und ihre Entdeckung gemacht wird. Die Liste der Preise, die ihr allein 2015 verliehen wurden, ist voll von renommierten Wissenschaftsauszeichnungen, darunter der Prinzessin-von-Asturien-Preis für wissenschaftliche und technische Forschung, der Louis-Jeantet-Preis für Medizin, der Ernst Jung-Preis für Medizin, der „Breakthrough“-Preis 2015 in den Lebenswissenschaften sowie der Leibniz-Preis 2016.
Skalpell für Forscher
Wie die vielfachen Auszeichnungen zeigen, ist Charpentiers Entdeckung eine der bemerkenswertesten Erfolgsgeschichten der Wissenschaft. Der Hauptdarsteller ist Teil des Immunsystems von Bakterien und hört auf den unaussprechlichen Namen CRISPR-Cas9. Wenn Viren ein Bakterium angreifen, schneiden Enzyme ein Stück aus der Viren-DNA heraus und bauen es an einer ganz bestimmten Stelle im Bakterienerbgut ein: am sogenannten CRISPR- Abschnitt. Die Zelle schreibt diesen Abschnitt dann in ein RNA-Molekül um, die CRISPR-RNA. Das Protein Cas9 wiederum schneidet das Erbgut eingedrungener Viren und setzt die Erreger dadurch außer Gefecht.
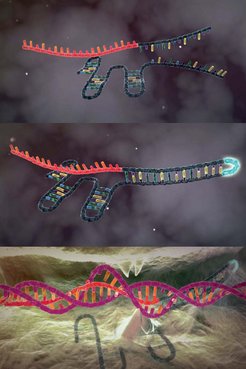
Charpentier beschrieb den neuen Mechanismus 2011 in einer Publikation im Fachmagazin nature: Demnach sind drei Komponenten am Prozess beteiligt: zwei RNA-Moleküle – CRISPR- RNA und tracrRNA genannt – sowie ein Enzym, das ursprünglich Csn1 genannt wurde und mittlerweile den Namen Cas9 trägt.
2012 veröffentlichte Charpentier mit ihren Kollegen im Magazin Science die Entdeckung, dass auch tracrRNA an dem Schneideprozess der DNA beteiligt ist. Cas9 wird durch die beiden RNA-Moleküle geleitet und schneidet die DNA des Virus an der durch die CRISPR- RNA ausgewählten Stelle. Emmanuelle Charpentier sah bereits damals voraus, dass ihre Entdeckung neue Möglichkeiten eröffnen könnte, um gezielt Gene anzusteuern und menschliche Genkrankheiten zu behandeln.
Charpentiers Arbeitsgruppe in Umeå kombinierte gemeinsam mit der Forschungsgruppe von Jennifer Doudna in Berkeley, Kalifornien, die beiden RNA-Moleküle zu einem einzigen Molekül. Dieser Schritt vereinfacht die Anwendung des CRISPR-Cas9-Werkzeugs, denn dadurch müssen Forscher nur ein RNA- Molekül auf die Gensequenz programmieren, die Cas9 schneiden soll.
Damit DNA an einer beliebigen Stelle geschnitten werden kann, müssen also nur die entsprechende Gensequenz bekannt sein und ein passendes RNA-Molekül hergestellt werden. An der Schneidestelle können Forscher dann ein neues DNA-Stück einsetzen und so Gene ein- und ausschalten.
Seit der Aufdeckung des CRISPR- Cas9-Mechanismus hat die molekulare Schere die Labore im Sturm erobert. Gab es 2012 noch 127 Veröffentlichungen zu CRISPR-Cas9, waren es 2013 bereits 277. Die Zahl schnellte 2015 auf beinahe 500 hoch, und in diesem Jahr könnten es über 1100 Studien werden. Wissenschaftler aus aller Welt untersuchen inzwischen CRISPR-Cas9 und wollen es weiterentwickeln. Vor allem aber nutzen sie es als Werkzeug zur Untersuchung von Genen. Da es sehr viel präziser, effizienter und kostengünstiger ist als bisherige Methoden, ist es in vielen Labors bereits unverzichtbar geworden.
Alle Experimente mit pflanzlichen, tierischen und menschlichen Zellen waren bislang erfolgreich. CRISPR-Cas9 besitzt daher ein Potenzial für unter- schiedlichste Anwendungen – von der Pflanzenzüchtung über die Züchtung von transgenen Labormäusen bis hin zur Therapie vielfältiger Krankheiten. Mediziner könnten damit Mutationen korrigieren und Erbkrankheiten heilen. In der HIV- und Malariaforschung wird es bereits eingesetzt.
Aus einem vor Kurzem nur eingefleischten Mikrobiologen bekannten Immunmechanismus von Bakterien könnte also schon bald eine medizinische Behandlungsmethode für Millionen von Patienten werden. Damit ist CRISPR- Cas9 ein Paradebeispiel für eine Überzeugung Charpentiers: „Grundlagenforschung ist für Fortschritt unverzichtbar“, betont sie bei jeder Gelegenheit. Eine Auffassung, mit der sie bei der Max-Planck-Gesellschaft natürlich genau richtig ist.
Die treibende Kraft hinter Charpentiers Forschung ist vor allem eine unstillbare Neugier auf die Welt und ihre komplexen Zusammenhänge. Das zeichnete sich schon in ihrer Kindheit ab. Charpentier wuchs in einem vielseitig interessierten Elternhaus südlich von Paris auf. Die Mutter arbeitete in der Psychiatrie, der Vater war verantwortlich für die Planung von Grünanlagen in der Stadt. Eine ihrer Schwestern begann gerade ihr Studium, als Emmanuelle in die Schule kam. Und von da an war ihr klar: Das wollte sie auch. Mehr noch als die Schule schien ihr die Universität der Ort des Lernens und der intellektuellen Auseinandersetzung zu sein.
Von der Musik zur Mikrobiologie
Dass sie einmal Biologin werden würde, war dagegen lange Zeit nicht ausgemacht. „Laut meiner Mutter habe ich zwar im Alter von elf oder zwölf Jahren einmal gesagt: Später werde ich am Institut Pasteur arbeiten – wo ich später tatsächlich meine Doktorarbeit gemacht habe“, erinnert sie sich mit einem Lächeln im Gesicht. „Aber eigentlich mochte ich in der Schule alle Fächer gern. Deshalb hätte ich auch etwas ganz anderes werden können.“

Privat hat Charpentier ein Faible für Kunst, Musik und Tanz. Sie hat Klavier gespielt und lange Jahre Ballett und modernen Tanz praktiziert – eine gute Übung nicht zuletzt für Disziplin und schöpferische Kraft, wie sie sagt: „Kunst hat einen wichtigen Einfluss auf meine wissenschaftliche Karriere: Du musst rigoros sein, aber dich auch gehen lassen können.“
Einen Beruf wollte sie aus dieser Begabung dann aber doch nicht machen: Nicht nur, weil es schwer ist, damit seinen Lebensunterhalt zu verdienen. Gerade beim Tanz ist die aktive Zeit doch recht bald vorbei, in der Wissenschaft hingegen kann man sich bis ins Alter immer weiterentwickeln.
Es war dann die Biologie mit ihrer Komplexität und dem direkten Bezug zum Menschen, die sie am meisten faszinierte. Biochemie zunächst, doch recht bald schon übernahmen Bakterien die Hauptrolle in ihrem Forscherleben. In ihrer Doktorarbeit untersuchte sie Mechanismen, die dazu führen, dass Bakterien Resistenzen gegen Antibiotika ausbilden. Damals zeichnete sich bereits ab, dass die Zahl multiresistenter Erreger rapide ansteigen würde.
Gleichzeitig wuchs das Bewusstsein dafür, dass wir auch sehr viel von ihnen lernen können. So hat die Erforschung von Bakterien in den 1970er-Jahren wichtige neue Labortechniken wie das Klonen von Genen hervorgebracht.
Es sind Überraschungen wie diese, die sie an ihrem Fach so spannend findet. Und die sie schon früh motiviert haben, sich auch nach Studium und Doktorarbeit immer wieder auf Neues einzulassen – sowohl thematisch als auch geografisch. Sie begann ihre wissenschaftliche Wanderschaft mit einer Postdocstelle in New York. Schon am Tag ihrer Ankunft erfuhr sie, dass ihre Arbeitsgruppe nach Memphis, Tennessee, umziehen würde. „In dem Moment musste ich mich an einen Ausspruch meiner Tante erinnern, einer Missionarin, die mir als kleinem Kind einmal prophezeit hatte, ich würde ein abenteuerliches, unstetes Leben führen. Bis zu jenem Zeitpunkt konnte ich damit nichts anfangen. Aber seit meiner Ankunft in New York bin ich eigentlich ständig unterwegs.“
Für Charpentier ist das auch ein Quell von Inspiration. Denn Orte zu verlassen bedeutet auch, immer wieder die eigene Komfortzone zu verlassen, sich und die eigene Arbeit zu hinterfragen und neu zu justieren. „Wahrscheinlich ist es genau das, was ich für meine Arbeit brauche“, sagt sie und empfiehlt das auch ihren Studenten. Thematisch wollte sie sich ebenfalls nicht einengen lassen, auch wenn das unter Wissenschaftskollegen manchmal kritisch gesehen wird. Dabei ist das doch so wichtig, um die eigene Nische zu finden.
Der Abschied von der Heimat erforderte zunächst auch einen Abschied von ihren Bakterien. Stattdessen wandte sich Charpentier nun deren Wirten zu und erforschte an Mäusen, wie sich die Haut der Tiere entwickelt und wie Mikroorganismen Hautinfektionen auslösen. Dabei lernte sie, wie mühsam es ist, das Mäuseerbgut so zu verändern, dass die Tiere als Modellsysteme für Krankheiten taugen. Diese Erfahrung brachte die Forscherin schließlich wieder zurück zu den Bakterien. Denn die waren schon oft Ausgangspunkt neuer Werkzeuge zur Genmanipulation.
Nach sechs Jahren als Postdoc in den USA bot sich ihr die Möglichkeit, im Biocenter der Universität Wien ihre erste eigene Forschungsgruppe aufzubauen. Das war ein wesentlicher Anreiz, wieder nach Europa zurückzukehren. „In Wien gab es eine starke Grundlagenforschung, hervorragende Kollegen, und ich konnte meine eigenen Themen setzen und völlig unabhängig arbeiten. Ich habe gelernt, in größeren Maßstäben zu denken, Forschungsgelder einzuwerben, aber auch mit knappen Mitteln zu wirtschaften.“
2009 zog es Charpentier aus Wien an die Universität Umeå in Schweden. Nicht wenige hielten sie damals für ein bisschen verrückt. „Der Schritt nach Umeå war durchaus riskant“, gibt sie zu. „Aber am Ende war es genau die richtige Entscheidung.“ Nicht zuletzt, weil ihr während des anfänglichen Pendelns im Flugzeug die entscheidende Idee kam, CRISPR mit RNA zusammenzubringen.
Es dauerte dann beinahe noch ein Jahr, bis sie eine Studentin fand, die ihre Idee auch im Labor umsetzen wollte: Ihre Masterstudentin Elitza Deltcheva hatte entscheidenden An- teil daran, weitere Kollegen der Gruppe für CRISPR-Cas9 zu begeistern.
Seit 2013 forscht die Französin nun in Deutschland. Das Land ist in Charpentiers Leben schon immer präsent gewesen. Ihre Eltern haben den Zweiten Weltkrieg miterlebt, sie selbst hat in der Schule Deutsch gelernt und im Rahmen eines Schüleraustauschs für zwei Wochen in das Leben einer deutschen Familie in einer rheinischen Kleinstadt schnuppern können. Zudem stammen viele ihrer Freunde und Kollegen in den USA, Österreich und Schweden aus Deutschland.
Das Helmholtz-Zentrum in Braunschweig und die Medizinische Hochschule Hannover haben sie unter anderem mit einer Alexander von Humboldt-Professur gelockt. Mit der Anbindung an die Medizinische Hochschule Hannover erhielt Charpentier Zugang zur klinischen Praxis – eine Verbindung, die sie sich nun in ähnlicher Weise zur Charité aufbauen möchte. Aber auch zu ihren früheren Kollegen in Hannover hält sie noch Kontakt.
In vielen Ländern fehlt der gesetzliche Rahmen
Daneben treiben zwei von ihr mitgegründete Unternehmen die Weiterentwicklung von CRISPR-Cas9 voran: CRISPR Therapeutics soll die Technologie als Behandlungsmethode bei Erbkrankheiten zur Marktreife bringen. Das Unternehmen möchte Patienten dabei Zellen entnehmen, diese mit CRISPR-Cas9 behandeln und dann wie- der in den Körper übertragen. Alternativ könnte CRISPR-Cas9 auch über spezielle Transportbehälter wie Fettbläschen oder Nanopartikel in den Körper eingeschleust werden. Darüber hinaus war Charpentier an der Gründung von ERS Genomics beteiligt und hat dem Unternehmen die Lizenzen für die Nutzung an anderen Organismen übertragen.

Bis Menschen mit CRISPR-Cas9 behandelt werden können, werden jedoch noch ein paar Jahre vergehen. Zuvor muss es noch mehr Klarheit über mögliche Risiken geben. Denn CRISPR-Cas9 arbeitet wesentlich präziser als andere Techniken, trotzdem macht es auch Fehler und schneidet gelegentlich das Erbgut an der falschen Stelle.
Hinzu kommen ethische Fragen, die eine Anwendung von CRISPR-Cas9 mit sich bringen können. Chinesische Forscher haben kürzlich das Erbgut menschlicher embryonaler Stammzellen verändert. Die Embryonen waren zwar nicht lebensfähig, die Versuche zeigen aber, dass Gesellschaft und Politik dringend vorgeben müssen, was erlaubt sein soll und was nicht. „CRISPR- Cas9 kann der Menschheit ungeheuer viel Gutes bringen, aber natürlich müssen wir verantwortungsbewusst damit umgehen. Eingriffe in die menschliche Keimbahn beispielsweise, die das Erbgut künftiger Generationen beeinflussen, lehnen die meisten meiner Kollegen und auch ich selbst ab“, stellt Charpentier klar. Letztlich ist es Aufgabe der Politik, dafür zu sorgen, dass das gewaltige Potenzial der Genschere nicht zur Erzeugung von Designerbabys missbraucht wird.
Charpentier freut sich auf die neue Herausforderung am Berliner Max-Planck-Institut. Der Ort bietet für ihre Forschung ideale Voraussetzungen: „Ich habe immer einen Platz gesucht, an dem ich meine Ideen frei entfalten und Wissenschaft unter exzellenten Bedingungen betreiben kann. Und ich habe auch immer davon geträumt, in einer Metropole wie Paris, London oder eben Berlin zu arbeiten.“ Insbesondere der unkonventionelle Geist der Stadt an der Spree ähnelt ihrem eigenen und könnte ihre Forschung inspirieren.
Vorerst allerdings wird ihr dafür wohl der tägliche Weg zum Institut genügen müssen, denn Zeit für das kulturelle Leben Berlins wird sie in den kommenden Monaten kaum haben. Schließlich läuft der Aufbau ihrer neuen Abteilung „Regulation in der Infektionsbiologie“ auf Hochtouren und erfordert eine Menge Energie: Labore werden umgebaut, ein Teil ihrer Mitarbeiter, die sie vom Helmholtz-Zentrum mitnimmt, ist mit dem Aufbau der Labore beschäftigt, damit die Forschung möglichst reibungslos weitergehen kann. Parallel dazu will sie die Kontakte zu den Kollegen an den benachbarten Instituten der beiden Berliner Universitäten und der Charité ausbauen.
Thematisch steht auch weiterhin das Verständnis der Regulationsmechanismen in Krankheitserregern im Fokus. Hier will sie zunächst einmal das zu Ende bringen, was sie mit CRISPR- Cas9 begonnen hat. Vor allem gilt es, die Biochemie des Systems noch besser zu verstehen, seine Spezifizität und Effizienz: „Wir sehen, dass es funktioniert, und wir verstehen die Grundlagen. Aber wie die Identifizierung der DNA-Abschnitte und das Ausschneiden im Detail ablaufen, das untersuchen wir noch.“ Außerdem will sie weitere CRISPR-Cas-Systeme untersuchen – vielleicht gibt es ja andere Schneidewerkzeuge im Reich der Bakterien, die für die Erforschung der Gene noch besser geeignet sind.
Mit alldem will Charpentier das Feld der Mikrobiologie am Institut stärken und exzellenten wissenschaftlichen Nachwuchs für diese biologische Disziplin anlocken. Das ist auch dringend geboten, denn in den kommenden Jahren gehen viele Mikrobiologen in den Ruhestand. Dazu kommt, dass die Mikrobiologie nicht gerade als ein Fach mit großer Zukunft gilt. Ein Fehlurteil, da ist Charpentier sich sicher – eines, das sie korrigieren möchte.
Text: Uta Deffke
GLOSSAR
CRISPR-Cas 9:
CRISPR steht für „Clustered Regularly Interspaced Short Palindromic Repeats“ und bezeichnet einen Abschnitt im Erbgut von Bakterien. Cas9 ist eine sogenannte Endonuklease – also ein Enzym, das DNA schneidet. Bei einer Infektion durch Viren schneiden die Bakterien Stücke aus dem Virenerbgut heraus und bauen es in den CRISPR-Abschnitt ein. Mit der daraus übersetzten CRISPR-RNA sowie einem weiteren RNA-Molekül können die Bakterien bei einer erneuten Attacke das Erbgut der Viren erkennen, es durchtrennen und die Erreger dadurch unschädlich machen. Das CRISPR- Cas9-System gibt dem bakteriellen Immunsystem auf diese Weise eine Art Gedächtnis.
RNA:
Das Erbgutmolekül DNA trägt die Bauanleitung sämtlicher Proteine eines Organismus. Diese Anleitung wird jedoch nicht direkt in Proteine übersetzt, sondern zunächst in einzelne, sehr viel kürzere RNA-Moleküle umgeschrieben. RNA ist chemisch etwas anders aufgebaut als DNA und liegt einzelsträngig vor. Es gibt verschiedene Arten von RNA-Molekülen: Manche dienen als Vorlage für die Produktion von Proteinen, andere wiederum steuern die Aktivität von Genen.



