Ein Biomolekül als Lichtschalter
Molekulare Mechanismus eines schaltbaren fluoreszierenden Proteins aufgeklärt
Schaltbare fluoreszierende Proteine, die sich reversibel zwischen einem ‚Ein’- und einem ‚Aus’-Zustand hin und herschalten lassen, sind erst seit wenigen Jahren bekannt, versprechen aber bereits eine Vielzahl neuartiger Anwendungen von der Zellbiologie bis hin zu Datenspeicherung. In einem Kooperationsprojekt haben Göttinger Zellbiologen, Röntgenkristallografen, Photobiophysiker und Computer-Biophysiker jetzt den molekularen Mechanismus entschlüsselt, mit dem ein fluoreszierendes Protein geschaltet wird (PNAS, 13. September 2005). Dieses Wissen könnte unter anderem für die optische Datenspeicherung in Proteinkristallen von Bedeutung sein.

Das fluoreszierende Protein mit der Bezeichnung asFP595 kommt in den Tentakelspitzen der Wachsrose Anemonia sulcata vor, einer Korallenart, die in den lichtdurchfluteten Flachwasserbereichen des Mittelmeers und des Nordatlantiks lebt (s. Abb. 1). In den Tentakelspitzen schützt dieses Protein die darunter liegenden Gewebe der Anemone wahrscheinlich vor zu starker Sonneneinstrahlung. asFP595 absorbiert grünes Licht und strahlt anschließend rotes Fluoreszenz-Licht wieder ab. Das Protein kann durch Licht beliebig zwischen einem fluoreszierenden und einem nicht-fluoreszierenden Zustand hin- und her geschaltet werden. Es ist ein ‚molekularer Lichtschalter’.
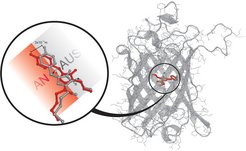
Die Göttinger Forscher haben den Mechanismus dieses molekularen Schalters aufgeklärt, indem sie das Protein zunächst in Bakterien hergestellt und dann Kristalle aus dem aufgereinigten Protein gezüchtet haben, die noch die Schalteigenschaften des freien Proteins besitzen. Röntgenstrukturanalysen und Computersimulationen zeigten, dass das Chromophor - der Teil des Proteins, der das Licht absorbiert - durch Beleuchtung mittels einer Cis-Trans-Isomerisierung seine Struktur ändert. Während das Chromophor einen so genannten Hula-Twist macht, ändert es seine Position um lediglich 3 x 10-10 Meter (ein Drittel eines Milliardstel Meters). Diese winzige Änderung reicht aus, um aus dem fluoreszierenden ein nicht-fluoreszierendes Protein zu machen.
Aufbauend auf diesem Wissen wollen die Forscher nun das Protein gezielt für den Einsatz in verschiedene Anwendungen verbessern. Diese reichen vom Einsatz in der höchstauflösenden Mikroskopie bis hin zur optischen Datenspeicherung in Proteinkristallen.