Arterien wachsen durch Aussprossen
Der Notch-Signalweg könnte Ansatzpunkt für neue Therapien bei Herzkreislauf-Erkrankungen sein
Die Bildung von Arterien ist ein elementares Ereignis von der Embryonalentwicklung bis ins Erwachsenenleben. Über die Mechanismen der Arterienbildung ist jedoch nicht viel bekannt. Ein Wissenschaftlerteam um Ralf Adams des Max-Planck-Instituts für molekulare Biomedizin in Münster haben zusammen mit Kollegen der Justus-Liebig-Universität Gießen herausgefunden, dass ein Rezeptor namens Notch in diesem Prozess essenziell ist: Hohe Notch-Aktivität bringt sprießende Zellen der vordersten Wachstumsfront dazu, sich in entwickelnde Arterien einzugliedern. Dies ist die erste Studie in Mäusen, die den Beweis für eine direkte Verbindung zwischen angiogener Sprossung und Arterienbildung liefert. Diese Erkenntnisse könnten dabei helfen, neue therapeutische Ansätze zu identifizieren, die die Bildung neuer Arterien nach Organverletzungen anregen.
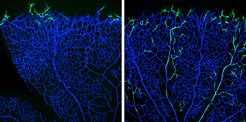
Das Blutgefäßsystem bildet ein komplexes Netzwerk von Arterien, Venen und Kapillaren und transportiert Sauerstoff, Nährstoffe, Zellen und Abfallprodukte durch unseren Körper. Geschädigte Arterien können zu Störungen des Herz-Kreislauf-Systems wie zum Beispiel Herzinfarkt oder Schlaganfälle führen und sind mittlerweile weltweit die häufigste Todesursache. Wie das Netz aus Blutgefäßen aufgebaut ist, ist noch nicht ausreichend gut erforscht – noch weniger ist bekannt, wie die Bildung von Arterien in therapeutischen Ansätzen stimuliert werden könnte.
Leitzellen geben die Richtung vor
Max Planck Wissenschaftler des Labors von Ralf Adams haben nun die Bildung neuer Blutgefäße aus einem bestehenden Kapillarnetzwerk – die sogenannte Angiogenese – im Gefäßnetzwerk der Netzhaut im Auge neugeborener Mäuse untersucht. „Die so genannten Leitzellen tasten im wachsenden Gefäßnetzwerk ihre Umgebung ab und weisen den nachfolgenden Endothelzellen die richtige Richtung“, sagt Mara Pitulescu, Erstautorin der Studie und Wissenschaftlerin in der Abteilung von Ralf Adams.
Den Leitzellen folgen teilungsfähige so genannte „Stalk“-Zellen (to stalk, engl.: verfolgen). Direkt hinter den Leit- und Stalk-Zellen sind die Blutgefäße zunächst in einem unausgereiften Plexus arrangiert, von dem aus Arterien, Venen und die verbindenden Kapillaren gebildet werden. Mittels Signalmoleküle interagieren Endothelzellen in diesem Netzwerk andauernd mit benachbarten Zellen und ihrer Umgebung. Vor allem der Notch-Rezeptor und sein Ligand Dll4 sind für die Angiogenese wichtig.
Pitulescu kombinierte genetische Experimente mit pharmakologischen Methoden. „Mit diesem Ansatz konnten wir zwischen Signalen für Zell-Zell-Interaktionen und der Signalkaskade innerhalb der Endothelzellen unterscheiden. Wir beobachteten, dass die Notch-Aktivierung an sich wichtiger ist als die eigentliche Notch-basierte Zell-Zell-Kommunikation“, erklärt Pitulescu.
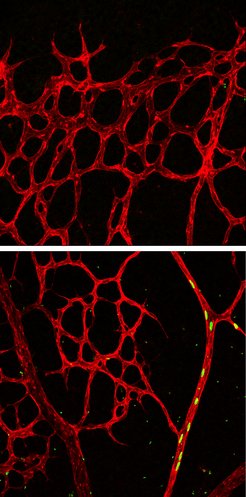
Bislang wurde vermutet, dass die unterversorgte Umgebung Signale abgibt, denen die Leit- und Stalk-Zellen folgen, während das Gefäßnetzwerkes hinter diesen Zellen in die unterversorgte Richtung mitwächst. Mit dem vaskulären Plexus erweitern sich auch die Arterien. In einer früheren Studie Arndt Siekmanns vom Max-Planck-Institut für molekulare Biomedizin konnte er in Zebrafischen zeigen, dass Arterien hauptsächlich durch Endothelzellen gebildet werden, die aus Venen sprießen und sich dann entgegen der allgemeinen Wachstumsrichtung bewegen.
Um die genauen Mechanismen der Arterienbildung in Mäusen zu studieren, verwendete die Wissenschaftler nun einen eleganten genetischen Ansatz, bei dem nur die Leitzellen und deren Abkömmlinge markiert werden und über die Zeit verfolgt werden können. „Erstaunlicherweise fanden wir heraus, dass die Abkömmlinge der Leitzellen entgegen der allgemeinen Wachstumsrichtung des Plexus wandern und sich innerhalb einiger Tage in Arterien integrieren“, sagt Pitulescu.
Leitzellen brauchen Chemokin-Rezeptor
Die Wissenschaftler haben den Notch-Ligand Dll4 in Leitzellen gezielt inaktiviert und beobachtet, wie sich das Gefäßnetzwerk ausbreitete. Interessanterweise ist Dll4 nicht erforderlich, um Leitzellen in ihrer Position am Rande des wachsenden Gefäßbettes zu halten. „Vielmehr fanden wir heraus, dass der für die Zellmigration wichtige Chemokin-Rezeptor CXCR4 für die Erhaltung der Leitzellen notwendig ist“, sagt Pitulescu. Die Experimente verdeutlichten allerdings die Rolle von Dll4: „Wenn Dll4 nicht vorhanden ist und der Notch-Rezeptor dadurch nicht aktiviert wird, verschlechtert sich die Rückwärts-Migration der Leitzellen“, sagt Pitulescu.
„Dies ist die erste Studie in Mäusen, in der gezeigt wird, dass die direkte Verbindung zwischen Sprossung und Arterienbildung gleichermaßen von Notch reguliert wird“, sagt Ralf Adams, der auch Professor der Medizinischen Fakultät der Westfälischen Wilhelms-Universität Münster und Mitglied des Exzellenzclusters „Cells in Motion“ ist. „Diese Ergebnisse sind von großer Bedeutung für das Verständnis des arteriellen Wachstums“, sagt Tilman Borggrefe, der mit seinem Team die biochemischen Analysen der Studie durchführte. „Dies könnte die Grundlage für einen neuen therapeutischen Ansatz sein, in dem bei Bedarf an Arterienbildung die Angiogenese über Notch kontrolliert werden könnte“, sagt Borggrefe.
JMK/HR