Forscher bremsen Parkinson bei Mäusen aus
Der Wirkstoff Anle138b verhindert Verklumpung von Synuclein-Protein
Die Parkinson-Krankheit beginnt schleichend. Dem amerikanischen Filmstar Michael J. Fox zuckte plötzlich bei Dreharbeiten der kleine Finger der linken Hand. Er überspielte es jahrelang erfolgreich. Typischerweise breitet sich das Zittern weiter aus, Muskeln werden steif, die Bewegungen verlangsamen sich. Wissenschaftlerteams um Armin Giese von der LMU München und Christian Griesinger vom Max-Planck-Institut für biophysikalische Chemie in Göttingen haben eine chemische Substanz entwickelt, die die Parkinson-Erkrankung in Tests an Mäusen verzögern kann. „Die Forscher hoffen, dass es auf diesem Weg möglich wird, Parkinson ursächlich zu behandeln und so die Krankheit zu stoppen.
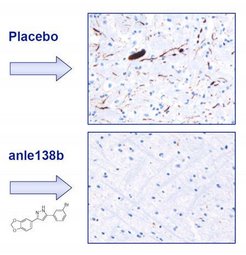
In den meisten Fällen tritt Parkinson bei Menschen zwischen 50 und 60 Jahren erstmals auf. Die Dopamin produzierenden Nervenzellen in der Substantia nigra, einer Struktur im Mittelhirn, gehen zugrunde. Unter dem Mikroskop werden auffallende Ablagerungen verklumpter Synuclein-Proteine im Gehirn sichtbar. In der frühen Phase lagern sich zunächst wenige Alpha-Synucleine zu sogenannten Oligomeren zusammen. Diese scheinen stark neurotoxisch zu wirken. Werden beim Menschen die ersten Symptome sichtbar, sind fatalerweise zumeist bereits mehr als die Hälfte der krankheitsrelevanten Nervenzellen abgestorben. Wissenschaftler forschen daher an verbesserten Methoden zur Früherkennung der Krankheit. Medikamentös können die Ursachen von Parkinson bisher nicht behandelt werden. Genau hier setzt die Arbeit der Forscher-Teams um Armin Giese und Christian Griesinger an.
Die Wissenschaftler haben jetzt einen Wirkstoff entwickelt, der in Tests an Mäusen das Fortschreiten der Proteinablagerungen und der Nervenzellschädigung in bisher nicht erreichtem Ausmaß verzögert und die krankheitsfreie Phase verlängert. „Das Besondere an unserer neuen Substanz ist, dass sie erstmals direkt an den Oligomeren ansetzt und ihre Bildung hemmt", erläutert Christian Griesinger, Leiter der Abteilung NMR-basierte Strukturbiologie am Max-Planck-Institut für biophysikalische Chemie. Die Entdeckung dieses Moleküls ist das Ergebnis jahrelanger Arbeit. „Der Schlüssel zum Erfolg war es, die Kompetenzen ganz unterschiedlicher Fachrichtungen zu bündeln. An der Entwicklung dieses Wirkstoffs waren Biologen, Chemiker, Mediziner, Physiker und Tiermediziner beteiligt“, sagt Armin Giese, Leiter einer Forschungsgruppe am Zentrum für Neuropathologie und Prionforschung der LMU München.
Rund 20.000 wirkstoffartige Substanzen testeten die Mitarbeiter um Giese systematisch darauf, ob sie die Bildung krankheitstypischer Proteinverklumpungen verhindern können. Ihr Screening basiert auf einer äußerst empfindlichen Laser-Methode, die der Mediziner Giese vor Jahren bei Nobelpreisträger Manfred Eigen am Max-Planck-Institut für biophysikalische Chemie entwickelt hat. Schon in der ersten Stufe fanden sich unter den getesteten Molekülen einzelne interessante Kandidaten. Eine Substanz erwies sich schließlich nach weiteren systematischen Optimierungen als besonders effektiv. Andrei Leonov, Chemiker in Griesingers Team, gelang es, daraus einen vielversprechenden Wirkstoff zu synthetisieren. Dieser ist in therapeutischen Dosen sehr gut verträglich, kann mit der Nahrung verabreicht werden und die Blut-Hirn-Schranke passieren. Im Gehirn erreicht er hohe Wirkspiegel. Inzwischen haben die Münchner und Göttinger Forscher den Wirkstoff namens Anle138b – nach den ersten beiden Buchstaben des Vor- und Nachnamens von Andrei Leonov – zum Patent angemeldet.
Anle138b könnte sich auch beim Menschen als therapeutischer Wirkstoff eignen. Dies lassen komplexe Versuchsreihen von Giese und seinen Mitarbeitern im Reagenzglas und am Tiermodell hoffen. Dazu kombinierten die Forscher nicht nur biochemische und strukturelle Methoden im Labor, sondern untersuchten die Wirkung von Anle138b auch an Parkinson-Mäusen in verschiedenen Tiermodellen, die in München und in Labors im Exzellenzcluster „Mikroskopie im Nanometerbereich und Molekularphysiologie des Gehirns“ (CNMPB) in Göttingen etabliert wurden. Erhielten Mäuse Anle138b, konnten sie ihre Bewegungen deutlich besser koordinieren als ihre unbehandelten kranken Artgenossen. „Wir können dies mit einer Art Fitnesstest direkt überprüfen“, erklärt Giese. „Wir setzen die Mäuse auf eine kleine rotierende Walze und messen die Zeit, wie lange die Nager darauf balancieren können“.
Generell war der Behandlungserfolg umso größer und die erkrankten Tiere lebten umso länger, je früher sie Anle138b über das Futter verabreicht bekamen. Doch nicht nur bei der Parkinson-Krankheit war die Substanz wirksam. „Auch bei Creutzfeldt-Jakob finden wir krankmachende Protein-Verklumpungen, die bei dieser Krankheit durch das sogenannte Prion-Protein verursacht werden“, erklärt Griesinger. „Auch hier verhindert Anle138b wirkungsvoll ihr Zusammenlagern und die Mäuse überleben deutlich länger“. Die Ergebnisse der Forscher machen Hoffnung, dass Anle138b möglicherweise auch das fatale Verklumpen anderer Proteine wie des mit Alzheimer assoziierten Tau-Proteins stoppen könnte. Weitere Versuche der Göttinger und Münchner Forscher sollen dies testen. Anle138b ist deshalb für die medizinische Forschung ein wichtiges Werkzeug. Es erlaubt den Wissenschaftlern, direkt im Reagenzglas zu untersuchen, wie der Wirkstoff die Oligomere verändert und was ihr Zusammenlagern hemmt. Sie hoffen, damit wichtige Einblicke in die Mechanismen zu erhalten, wie neurodegenerative Krankheiten entstehen.
Bis heute werden durch die verfügbaren Medikamente nur die Symptome der Parkinson-Krankheit gelindert, indem sie die Funktion der verbliebenen Nervenzellen unterstützen. „Mit Anle138b könnten wir eine neue Klasse von Neuroprotektiva zur Hand haben, mit der sich möglicherweise Krankheiten wie Parkinson oder Creutzfeldt-Jakob bremsen oder sogar stoppen lässt“, erläutert Griesinger. Doch er warnt, dass die Ergebnisse an Nagern nicht unmittelbar auf den Menschen übertragbar seien. Im nächsten Schritt soll Anle138b auf Toxizität an Nichtnagern getestet werden. Erst wenn diese Versuche positiv verlaufen, rücken klinische Studien am Menschen in greifbare Nähe. „Es ist aber immer ein langer Weg, bis eine neue Substanz beim Menschen in der Therapie erfolgreich eingesetzt werden kann“, betont Mediziner Giese.
cr/HR
