Forschungsbericht 2011 - Max-Planck-Institut für Biologie des Alterns
Einblicke in die Nanowelt der Mitochondrien und die Organisation ihres Erbgutes
Insights into the nanoworld of mitochondria and the organisation of their genome
Die Kraftwerke unserer Zellen: Mitochondrien

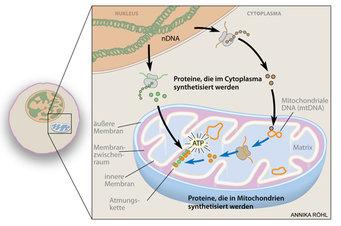
Säugetierzellen besitzen einen Zellkern, in dem der Hauptbestandteil der Erbinformationen kodiert vorliegt, und andere Zellorganellen, die diverse Funktionen innerhalb einer Zelle übernehmen. Einer der wichtigsten Zellbestandteile sind die Mitochondrien (Abb. 1). Sie sind die so genannten Kraftwerke der Zellen und für die Energieversorgung des Organismus zuständig. Man nimmt an, dass Mitochondrien einstmals eigenständige Bakterien waren und dass diese eine Symbiose mit einer ursprünglichen, einfachen Vorläuferzelle eingegangen sind. Wissenschaftler begründen diese Hypothese mit der Tatsache, dass Mitochondrien eine doppelte Zellmembran und ihr eigenes, spezialisiertes Genom besitzen. Dieses mitochondriale Genom kodiert einige äußerst wichtige Proteine, doch nur im Zusammenspiel mit der Information aus dem Zellkern können die vorgesehenen Funktionen vollständig erfüllt werden. Durch den Zusammenschluss von Vorläuferzelle und Bakterium und der anschließenden Weiterentwicklung dieser Symbiose hat sich eine untrennbare und fein regulierte Einheit, die eukaryotische Zelle, ausgebildet.
Eine universelle Energiequelle versorgt alle Prozesse im Körper
Mitochondrien sind abgegrenzte Organellen, die von einer doppelten Zellmembran umgeben sind. In der inneren Membran sind die Proteinkomplexe der Atmungskette lokalisiert. Bei der Zellatmung entsteht im Laufe eines chemiosmotischen Vorgangs Energie in Form des Moleküls Adenosintriphosphat (ATP). Dazu werden Elektronen entlang der inneren Mitochondrienmembran von einem auf den nächsten Proteinkomplex geleitet, insgesamt über drei Stationen. Am Ende werden die Elektronen auf Sauerstoff übertragen, es entsteht Wasser. Im Verlauf des Elektronentransports werden Protonen nach außen transportiert, wodurch ein Ladungsunterschied auf beiden Seiten der inneren Mitochondrienmembran entsteht. Dieser Protonengradient wird durch so genannte ATP-Synthasen genutzt. Durch deren kanalartigen Durchlass können die Protonen wieder kontrolliert in den Innenraum des Mitochondriums geleitet werden; dabei wird die aufgrund des Protonengradienten vorhandene Energie zur Erzeugung von ATP genutzt. ATP ist ein Zwischenspeicher für Energie und eine universelle Energiequelle, die in allen Geweben verwendet werden kann.
Einige Gene der mitochondrialen DNA kodieren bestimmte Untereinheiten derjenigen Proteine, die an der Atmungskette beteiligt sind, andere Untereinheiten wiederum sind im Zellkern kodiert. Das Zusammenspiel zwischen der mitochondrialen und der nuklearen DNA erfordert demnach eine präzise Abstimmung zwischen den beiden Genomen. Kleinste Unregelmäßigkeiten oder die fehlerhafte Herstellung eines dieser Proteine führen zur Dysfunktion der Mitochondrien [1]. Eine Reihe von klinischen Pathologien wurde in deren Folge beschrieben, wie zum Beispiel Kardiomyopathie (eine Herzkrankheit), Demenz und Ataxie (eine Krankheit, die sich durch unkoordinierte Bewegungen bemerkbar macht). Nach Anhäufung von Mutationen in der mitochondrialen DNA und der daraus resultierenden mitochondrialen Dysfunktion wurden auch die typischen Phänomene des Alterns, wie Entstehung von Osteoporose, Ergrauen und Haarverlust, Gewichtsreduktion und Verlust des subkutanen Fettgewebes, Blutarmut, Vergrößerung des Herzens, Taubheit und verminderte Lebenserwartung beschrieben. Darüber hinaus konnte gezeigt werden, dass eine Fehlfunktion der Mitochondrien zur Entwicklung von altersassoziierten Erkrankungen wie Diabetes mellitus und Parkinson beiträgt [2].
Nukleoide, die organisatorische Einheit in Mitochondrien

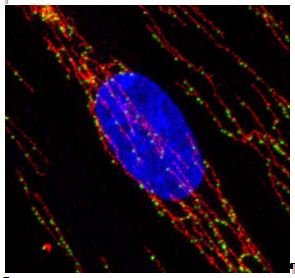
In den Mitochondrien selbst sind Erbgut und Proteine in Komplexen organisiert, den so genannten mitochondrialen Nukleoiden. Diese Einheiten spielen eine wichtige Rolle bei der Vererbung, da das mitochondriale Erbgut nur von der Mutter auf das Kind vererbt wird (Abb. 2).
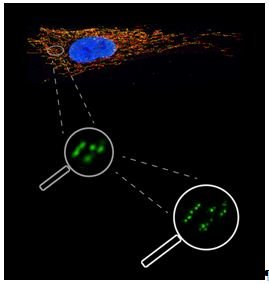
Die mitochondrialen Nukleoid-Komplexe können als punktförmige Strukturen im Mikroskop sichtbar gemacht werden. Die Auflösungsgrenze herkömmlicher Lichtmikroskopie liegt bei etwa 250 Nanometern, was immerhin einem millionstel Millimeter entspricht. Aber selbst diese beeindruckende Auflösung ist noch zu grob und erlaubte bisher keinen genaueren Einblick in die Struktur der Nukleoide. Genau hier haben die Forscher aus Köln, Göteborg und Göttingen mit modernster hochauflösender STED-Mikroskopie angesetzt, die am Max-Planck-Institut für biophysikalische Chemie in der Arbeitsgruppe von Stefan Hell entwickelt wurde. Mithilfe dieser Technologie kann eine 5-fach höhere Auflösung erreicht werden als bisher (Abb. 3).

Die Arbeitsgruppen um Stefan Jakobs, Max-Planck-Institut für biophysikalische Chemie, und Nils-Göran Larsson, Max-Planck-Institut für Biologie des Alterns, untersuchten mitochondriale Nukleoide mit unterschiedlichen Methoden. In verschiedenen Organismen wie Mensch, Maus, aber auch grüne Meerkatze oder australischer Beutelratte fanden die Wissenschaftler mitochondriale Nukleoide, die im Durchschnitt mit etwa 100 Nanometern weitaus kleiner waren als bisher angenommen. Die Forscher kombinierten die hochauflösende Mikroskopie mit molekularbiologischen Techniken und stellten fest, dass die meisten Nukleoide nur ein einziges Molekül des mitochondrialen Erbguts enthalten. Dies war eine erstaunliche Entdeckung, denn bisher wurde angenommen, dass die Erbgut-Protein-Komplexe in den Mitochondrien zwei bis zehn Kopien mitochondrialer DNA enthalten. Zwischen den verschiedenen Organismen wurden beachtliche Übereinstimmungen vorgefunden, was die Organisation der mitochondrialen Nukleoide betrifft. Das mitochondriale Erbgut liegt nicht „nackt“ in den Nukleoiden vor, sondern wird von dem Protein TFAM (mitochondrialer Transkriptionsfaktor A) verpackt. Dieses Verpackungsprotein ist gleichzeitig auch für die Transkription, also das Abschreiben mitochondrialer Gene, nötig. Es besitzt demnach zwei Funktionen. In der Studie wurde herausgefunden, dass etwa 1000 TFAM-Moleküle zusammen mit der mitochondrialen DNA in einem Nukleoid vorhanden sind. Durch Volumenberechnungen hat sich gezeigt, dass TFAM somit ein Hauptbestandteil der mitochondrialen Nukleoid-Komplexe ist [3]. Natürlich sind noch weitere Proteinkomponenten verschiedenster Art mit den mitochondrialen Nukleoiden assoziiert, um beispielsweise die DNA zu kopieren oder reparieren zu können.
Diese fundamentalen Einblicke in die organisatorische Struktur des mitochondrialen Erbguts sind von besonderer Bedeutung für das Verständnis von Krankheiten, die mitochondrial, also von der Mutter auf die Kinder, vererbt werden. Dazu zählen beispielsweise die chronisch progrediente externe Ophthalmoplegie (Augenmuskellähmung), hereditäre motorisch-sensible Neuropathie (Muskelschwund) und die MELAS-Erkrankung (Mitochondriale Myopathie: eine schwere neurologische Erkrankung, die zu unkoordinierten Bewegungen führt und in seltenen Fällen mit einem so genannten mitochondrialen Diabetes mellitus einhergeht).
Darüber hinaus ist seit längerem bekannt, dass ein Zusammenhang zwischen den Kraftwerken der Zelle und dem Altern besteht. Im Alter können sich natürlich auftretende Mutationen in der mitochondrialen DNA anhäufen, die die Energieproduktion der Zellen und somit die Versorgung der Organe beeinflussen.