Forschungsbericht 2008 - Max-Planck-Institut für Hirnforschung
Die duale Rolle des Neurotransmitters Glyzin im zentralen Nervensystem
The dual role of the neurotransmitter Glycine in the CNS
Neurochemie (Prof. Dr. Heinrich Betz)
MPI für Hirnforschung, Frankfurt/Main
Einleitung
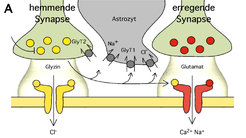
Die schnelle Signalübertragung zwischen Nervenzellen erfolgt an spezialisierten Kontaktstellen (Synapsen) mittels kleiner Botenstoffe, den so genannten Neurotransmittern. Ihre regulierte Freisetzung aktiviert spezifische Rezeptoren in nachgeschalteten Nervenzellen. Die Aktivierung dieser Rezeptoren führt dazu, dass die Zielzellen in Abhängigkeit von ihrer Ionenleitfähigkeit entweder angeregt oder in ihrer Aktivität gehemmt werden. Das Zusammenspiel von erregend bzw. hemmend wirkenden Rezeptoren auf den Nervenzellen des zentralen Nervensystems (ZNS) bildet die Grundlage für die Funktion unseres Gehirns und führt bei gestörtem Gleichgewicht zu neurologischen Erkrankungen, wie zum Beispiel Epilepsie oder Schizophrenie. Die Bindung des Neurotransmitters an den Rezeptor und die Öffnung des Rezeptor-Ionenkanals stellen die Schlüsselreaktionen der Rezeptoraktivierung dar, die durch eine Vielzahl von Mechanismen und Substanzen moduliert, d. h. in ihren Eigenschaften verändert werden kann. Interessanterweise wirkt die einfachste aller Aminosäuren, das Glyzin, als hemmender und erregender Neurotransmitter, indem sie an hemmende Glyzinrezeptoren (GlyR) beziehungsweise erregende NMDA-Rezeptoren (NMDAR) bindet (Abb. 1A). Durch den Vergleich dieser phylogenetisch unterschiedlichen Rezeptorfamilien versucht die Arbeitsgruppe um Bodo Laube und Heinrich Betz sowohl molekulare Determinanten und Mechanismen der Glyzin-induzierten Rezeptoraktivierung und -modulation als auch deren Einfluss auf die synaptische Übertragungseffizienz zwischen Nervenzellen zu entschlüsseln.
Die „klassischen“ Wirkorte des Neurotransmitters Glyzin
![Die Rolle von Glyzin an hemmenden und erregenden Synapsen Aufsichten des Glyzinrezeptors und des NMDA-Rezeptors. Der für Chloridionen selektive inhibitorische GlyR besteht aus einem fünf Untereinheiten umfassenden membranständigen Rezeptorkomplex (links). Die Bindungsstelle von Glyzin liegt an der Kontaktfläche benachbarter Untereinheiten. Der Kationen leitende exzitatorische NMDAR (rechts) ist ein Vertreter der aus vier Untereinheiten bestehenden Glutamatrezeptor-Familie und benötigt die simultane Bindung der Transmitter Glutamat und Glyzin für die Kanalaktivierung [3]. Die Bindung von Glyzin und Glutamat erfolgt am NMDAR zwischen zwei Proteindomänen (S1, S2) der sog. NR1- bzw. NR2-Untereinheiten ähnlich einem „Venus-Fliegenfallen-Mechanismus“. Nach der Rezeptorbindung wird das Glyzin durch die Glyzintransporter GlyT1 und GlyT2 aus der Synapse entfernt.](/312908/original-1572010259.jpg?t=eyJ3aWR0aCI6MjQ2LCJvYmpfaWQiOjMxMjkwOH0%3D--4cda4d5fb5f54a4c127c84fe25d4f64ff7122de9)
Der für Chloridionen selektive inhibitorische GlyR im Rückenmark von Säugern besteht aus einem fünf Untereinheiten umfassenden membranständigen Rezeptorkomplex (Abb. 1B) und ist maßgeblich an der spinalen Kontrolle des Muskeltonus beteiligt [1; 2]. Seine Blockade durch das kompetitiv zur Glyzinbindung wirkende pflanzliche Alkaloid Strychnin und bei neurologischen Erkrankungen (hereditäre Hyperekplexie) auftretende Mutationen in GlyR-Genen resultieren in Muskelkrämpfen (Myoklonien). Der exzitatorische NMDA-Rezeptor ist ein im ZNS weit verbreiteter Vertreter der aus vier Untereinheiten bestehenden Glutamatrezeptor-Familie (Abb. 1B) und benötigt die simultane Bindung der Transmitter-Aminosäuren Glutamat und Glyzin für die Kanalaktivierung [3]. Er besitzt eine hohe Leitfähigkeit für Ca2+-Ionen und stellt eine der molekularen Grundlagen der Plastizität des Nervensystems, d.h. seiner Fähigkeit zu Veränderung und Anpassung, und damit letztlich von Lernvorgängen dar. Die hohe Permeabilität des NMDAR für Ca2+ steuert jedoch nicht nur zelluläre Prozesse, sondern führt bei exzessiver Aktivierung des Rezeptors, beispielsweise nach einem ZNS-Trauma, auch zum neuronalen Zelltod in vivo.
In den letzten Jahren konnten die Wissenschaftler am MPI für Hirnforschung grundlegende Unterschiede und Gemeinsamkeiten zwischen diesen beiden Rezeptortypen bezüglich ihres Aufbaus, der Membrantopologie ihrer Untereinheiten, deren Stöchiometrie und ihrer Wechselwirkung mit Liganden herausarbeiten [1-6]. So ergab zum Beispiel die Untersuchung der Agonistenbindungstaschen, dass in beiden Rezeptoren ionische Wechselwirkungen zur Glyzinbindung beitragen [2; 4]. Die Bindung von Glyzin und Glutamat erfolgt jedoch am NMDAR zwischen zwei Proteindomänen (S1, S2) der sog. NR1- bzw. NR2-Untereinheiten ähnlich einem „Venus-Fliegenfallen-Mechanismus“. Die Bindungsstelle von Glyzin am GlyR liegt dagegen an der Kontaktfläche benachbarter Untereinheiten (Abb. 1B).
Der erregende Glyzinrezeptor
Neuere Untersuchungen ergaben, dass Glyzin auch in Abwesenheit von Glutamat als alleiniger Agonist an einem bestimmten NMDA-Rezeptor wirken kann, der im Gegensatz zum klassischen Strychnin-sensitiven, hemmenden GlyR als „exzitatorischer Glyzinrezeptor“ bezeichnet wurde. Im Gegensatz zum „klassischen“ NMDAR, der aus zwei Glyzin-bindenden NR1- und zwei Glutamat-bindenden NR2-Untereinheiten besteht [3], enthält der exzitatorische Glyzinrezeptor anstatt der NR2-Untereinheiten Glyzin-bindende NR3-Untereinheiten. Da die Koexpression einer NR3-Untereinheit mit der Glyzin-bindenden NR1-Untereinheit im Gegensatz zu den klassischen NR1/NR2-Rezeptoren nur sehr kleine und rasch desensitisierende Rezeptorströme produziert, wurde die Existenz so genannter „exzitatorischer“ Glyzinrezeptoren jahrelang in Frage gestellt. Ziel der Untersuchungen in den letzten zwei Jahren war, sowohl den molekularen Aufbau als auch die Aktivierung dieser Glyzin-gesteuerten NR1/NR3-Rezeptoren zu verstehen.
Stöchiometrie des NR1/NR3-Rezeptors
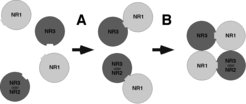
In einer ersten Studie wurde der Zusammenbau der NR1- und NR3-Untereinheiten zum funktionellen Rezeptor untersucht. Um die Assemblierung der Untereinheiten zu beobachten, wurden fluoreszierende Proteinsequenzen an die Untereinheiten angehängt und die räumliche Orientierung im Rezeptorkomplex mittels sog. Fluoreszenz-Energie-Transfers (FRET) analysiert. Dieser Ansatz wurde mit einer biochemischen Methode, der nativen Gelelektrophorese, kombiniert, für die die entsprechenden Untereinheiten metabolisch radioaktiv markiert und aufgereinigt wurden. Beide Verfahren bestätigten die Ausbildung von initialen NR1/NR3-Heterodimeren. Aus diesen Studien leiteten die Frankfurter Wissenschaftler ein zweistufiges Modell der Rezeptorbiosynthese von NMDA-Rezeptoren ab, bei dem der erste grundlegende Schritt die Bildung eines NR1/NR3-Heterodimers ist, gefolgt von der Anlagerung eines weiteren Heterodimers zum funktionellen tetrameren Rezeptorkomplex [5], (Abb. 2).
Rolle der Glyzinbindung an NR1/NR3-Rezeptoren
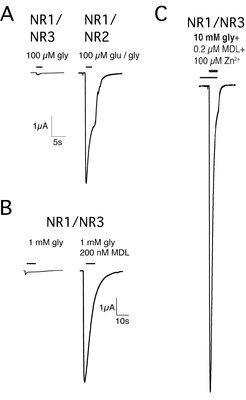
Die Untersuchungen zeigten, dass die NMDARs des sog. „exzitatorischen Glyzinrezeptortyps“ aus einer Kombination von je zwei Glyzin-bindenden NR1- und NR3-Untereinheiten bestehen [5]. Ziel weiterer Studien war die pharmakologische Charakterisierung dieser Rezeptoren mittels biochemischer und elektrophysiologischer Analysemethoden. Der Vergleich der Expressionseffizienz membranständiger NR1/NR3-Rezeptoren mit der von klassischen NR1/NR2-Rezeptoren ergab ähnliche Werte, jedoch lieferten NR1/NR3-Rezeptoren nur kaum messbare Glyzin-induzierte Ströme, die im Vergleich zu NR1/NR2-Rezeptoren wesentlich geringer ausfielen [7], (Abb. 3A). Die pharmakologische Analyse spezifischer Antagonisten der NR1- und NR3-Untereinheiten ergab, dass die Glyzinströme der NR1/NR3-Rezeptoren in Gegenwart eines NR3-Antagonisten gehemmt, jedoch überraschenderweise von einem spezifischen Antagonisten für die NR1-Untereinheit um den Faktor 25 potenziert wurden (Abb. 3B). Sie waren somit vergleichbar mit den Strömen der klassischen NMDAR, die aus NR1- und N2-Untereinheiten bestehen. Die zielgerichtete Mutagenese der Glyzinbindungstaschen der jeweiligen Untereinheiten bestätigte die pharmakologischen Ergebnisse.
Zusammenfassend bedeutet dieses Ergebnis, dass Glyzin durch die Bindung an die NR1-Untereinheit den Rezeptor inhibiert, während die Glyzinbindung an die NR3-Untereinheit zur Aktivierung von NR1/NR3-Rezeptoren führt.
Modell der Rezeptoraktivierung
Basierend auf den beschriebenen Befunden und der aufgrund unterschiedlicher Affinitäten sequenziellen Bindung des Neurotransmitters Glyzin an die NR3- und NR1-Untereinheiten schlagen Laube und Betz für die Aktivierung des NR1/NR3-Rezeptors folgendes Modell vor [7], (Abb. 4):
1) Die Bindung von Glyzin an die beiden NR3-Bindungstaschen resultiert in einer Öffnung des Rezeptor-Ionenkanals (Abb. 4A).
2) Die nachfolgende Bindung von Glyzin an die niedriger affine NR1-Untereinheit bewirkt eine Schwächung der Wechselwirkungen zwischen den die Bindungstaschen enthaltenden extrazellulären Rezeptordomänen, sodass der Rezeptor in den geschlossenen, desensitisierten Zustand überführt wird (Abb. 4B).
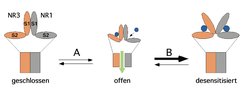
Dieses Modell basiert auf Ergebnissen, welche zeigen, dass die kleinen, rasch desensitisierenden NR1/NR3-Rezeptorströme durch NR1-Antagonisten oder Mutationen in der NR1-Glyzinbindungstasche in starke nicht-desensitisierende Ströme überführt werden.
Der Neuromodulator Zn2+ und seine Wirkung am GlyR
![Verlust der Zn2+-induzierten Verstärkung glyzinerger Hemmung resultiert in einer erhöhten Schreckreaktion A: Pentameres Modell der extrazellulären Ligandenbindungsdomäne des GlyR (Aufsicht) [2]. Links: Bindung von Zn2+ (hellgrün) an der Schnittstelle von benachbarten Untereinheiten des GlyR führt zu einer Veränderung der Wechselwirkungen. Rechts: Verlust der Zink-Bindung nach Mutation der Bindungsstelle [10]. B: Phänotyp einer gesunden (links) und einer „hyperekplektischen“ (rechts) Maus mit mutierter GlyR-Zn2+-Bindungsstelle. Die verstärkte Schreckreaktion zeigt sich in einer Verspannung der Hinterbeine. C: Schema zur verstärkenden Funktion von Zn2+ an hemmenden Synapsen. Zn2+ ist essentiell für die Verstärkung der Glyzinrezeptorantwort (links). Die Bindung von Zink (rot) führt zum vermehrten Einstrom von Chloridionen und somit zu einer Verstärkung der hemmenden Wirkung von Glyzin (links, schwarze Pfeile). Mutation der Zinkbindungsstelle am GlyR verhindert die Zink-bedingte Verstärkung des Chlorideinstroms und bedingt in der genetisch veränderten Maus Symptome ähnlich der menschlichen Schreckerkrankung „Hyperekplexie“ (rechts) [11].](/313132/original-1572010258.jpg?t=eyJ3aWR0aCI6MjQ2LCJvYmpfaWQiOjMxMzEzMn0%3D--2af1f1fbcda0a7d9d873e81875ae93e91ee02b84)
Das zweiwertige Kation Zn2+ ist aufgrund seiner ubiquitären Beteiligung an vielen biologischen Reaktionen ein essenzielles Spurenelement im Körper; es erfüllt vielfältige Aufgaben als Kofaktor von Proteinen. Im Gehirn ist Zn2+ massiv in erregenden Neuronen einer bestimmten Hirnregion (Hippocampus) angereichert, die besonders stark NMDARs exprimiert und eine wichtige Rolle bei der Gedächtnisbildung, bei Emotionen und Lernvorgängen spielt. Neueste Untersuchungen belegen auch eine Anreicherung von Zn2+ in den synaptischen Endigungen inhibitorischer Neurone, die eine starke Expression von GlyRs zeigen. In der Arbeitsgruppe von Betz und Laube konnte mit Zn2+ eine starke Potenzierung der hemmenden Glyzinantwort in kultivierten Neuronen nachgewiesen werden [8]. Basierend auf Strukturmodellen [9] und umfangreichen Mutationsanalysen [10] konnte die Zn2+-Bindungsstelle im extrazellulären Bereich des GlyR identifiziert werden (Abb. 5A). Um die physiologische Bedeutung der Zn2+-Regulation in der glyzinergen Signalübertragung im Gehirn von Säugern auf synaptischer Ebene zu belegen, wurde in genetisch modifizierten Mäusen durch Mutation der Zn2+-Bindungsstelle der GlyR Zn2+-insensitiv gemacht [11], (Abb. 5A). Der Verlust der Zn2+-Bindung führt in der genetisch veränderten Maus zu Krämpfen, einem erhöhten Muskeltonus und einer verstärkten Schreckreaktion, die sich in einer ungewöhnlichen Verspannung der Hinterbeine widerspiegelt (Abb. 5B). Diese Symptome ähneln denen einer Strychninvergiftung und der menschlichen Erbkrankheit Hyperekplexie und sind konsistent mit einer Reduktion der Glyzin-vermittelten neuronalen Hemmung. Elektrophysiologische Messungen an Hirnschnitten bestätigten, dass die Erkrankung der Maus auf den Verlust der Zn2+-Wirkung am GlyR zurückzuführen ist. Diese Ergebnisse zeigten zum ersten Mal, dass Zn2+ ein wichtiger endogener Regulator bei der hemmenden glyzinergen synaptischen Erregungsübertragung im Gehirn ist [11](Abb. 5C).
Die Wirkung von Zn2+ auf erregende Rezeptoren
In vielen Arbeiten war gezeigt worden, dass Zn2+-Konzentrationen im niedrigen mikromolaren Bereich beim klassischen NMDAR eine Hemmung der Glutamat-verursachten Erregbarkeit von Nervenzellen bedingt. Die Wissenschaften fanden, dass diese Zn2+-Hemmung des klassischen NR1/NR2-Rezeptors nach dem enzymatischen Abschneiden der sog. N-terminalen Domäne der NR1-Untereinheit aufgehoben ist [12]. Der Gewebeplasminogen-Aktivator t-PA, eine Serinprotease, die ebenfalls die extrazelluläre Domäne der NR1-Untereinheit entfernt, ist an pathophysiologischen Aspekten der Erregungsübertragung zwischen Nervenzellen beteiligt. Ihre Blockade vermindert den NMDA-Rezeptor-vermittelten exzitatorischen Zelltod. Die Ergebnisse lassen vermuten, dass eine t-PA-mediierte Aufhebung der tonischen Zn2+-Hemmung von NMDARs zu einem erhöhten Ca2+-Einstrom und neuronalem Zelltod führen könnte. In der Tat konnten die Wissenschaftler am MPI im Zellkultursystem zeigen, dass Zn2+ eine neuroprotektive Wirkung auf Glutamat-vermittelte Toxizität besitzt [13]. Folglich wurde in einer weiteren Studie die Wirkung von Zn2+ auf die Glyzin-aktivierten Ströme von NR1/NR3-Rezeptoren untersucht. Dabei wurde gefunden, dass mikromolare Zn2+-Konzentrationen die Glyzin-induzierten Ströme der Rezeptoren um den Faktor 10 erhöhen [14]. Höhere Zn2+-Konzentrationen führten wie Glyzin zu einer Aktivierung von NR1/NR3-Rezeptoren. Erstaunlicherweise bewirkte in Anwesenheit von Zn2+ die gemeinsame Applikation von Glyzin und einem NR1-Antagonisten eine 125-fache, „supralineare“ Potenzierung des Glyzin-aktivierten Rezeptorstromes [14], (Abb. 3C). Zusammenfassend zeigen die Ergebnisse, dass Zn2+ sowohl als positiver Modulator als auch als voller Agonist an NR1/NR3-Rezeptoren wirken kann.
Schlussbemerkung
Bisher existieren nur wenige Studien, die das Vorkommen bzw. die Aktivierung nativer NR1/NR3-Rezeptoren beschreiben. Die durch diese Arbeit beschriebene supralineare Potenzierung könnte einen Weg eröffnen, um NR1/NR3-Rezeptoren in vivo einfacher nachzuweisen und funktionell zu charakterisieren. Die neuen Erkenntnisse über das Aktivierungsverhalten von NR1/NR3-Rezeptoren lassen weiterhin vermuten, dass Zn2+ neben Glyzin für die Aktivierung von nativen NR1/NR3-Rezeptoren physiologisch von wesentlicher Bedeutung sein könnte. Da bisherige Studien noch keine verlässlichen Daten zu den im Gehirn synaptisch freigesetzten Zn2+-Konzentrationen liefern, planen die Wissenschaftler, durch die gezielte Expression eines sog. „Zn2+-Snifferrezeptors“ [9] die synaptische Ausschüttung von Zn2+ im ZNS von Mäusen nachweisbar zu machen.
Die Untersuchungen zur Wirkung von Glyzin und Zn2+ am GlyR und NMDAR sind ein gemeinsames Projekt der Abteilung Neurochemie (MPI für Hirnforschung) und der AG Molekulare und Zelluläre Neurophysiologie, TU Darmstadt.

![Die Rolle von Glyzin an hemmenden und erregenden Synapsen Aufsichten des Glyzinrezeptors und des NMDA-Rezeptors. Der für Chloridionen selektive inhibitorische GlyR besteht aus einem fünf Untereinheiten umfassenden membranständigen Rezeptorkomplex (links). Die Bindungsstelle von Glyzin liegt an der Kontaktfläche benachbarter Untereinheiten. Der Kationen leitende exzitatorische NMDAR (rechts) ist ein Vertreter der aus vier Untereinheiten bestehenden Glutamatrezeptor-Familie und benötigt die simultane Bindung der Transmitter Glutamat und Glyzin für die Kanalaktivierung [3]. Die Bindung von Glyzin und Glutamat erfolgt am NMDAR zwischen zwei Proteindomänen (S1, S2) der sog. NR1- bzw. NR2-Untereinheiten ähnlich einem „Venus-Fliegenfallen-Mechanismus“. Nach der Rezeptorbindung wird das Glyzin durch die Glyzintransporter GlyT1 und GlyT2 aus der Synapse entfernt. Die Rolle von Glyzin an hemmenden und erregenden Synapsen Aufsichten des Glyzinrezeptors und des NMDA-Rezeptors. Der für Chloridionen selektive inhibitorische GlyR besteht aus einem fünf Untereinheiten umfassenden membranständigen Rezeptorkomplex (links). Die Bindungsstelle von Glyzin liegt an der Kontaktfläche benachbarter Untereinheiten. Der Kationen leitende exzitatorische NMDAR (rechts) ist ein Vertreter der aus vier Untereinheiten bestehenden Glutamatrezeptor-Familie und benötigt die simultane Bindung der Transmitter Glutamat und Glyzin für die Kanalaktivierung [3]. Die Bindung von Glyzin und Glutamat erfolgt am NMDAR zwischen zwei Proteindomänen (S1, S2) der sog. NR1- bzw. NR2-Untereinheiten ähnlich einem „Venus-Fliegenfallen-Mechanismus“. Nach der Rezeptorbindung wird das Glyzin durch die Glyzintransporter GlyT1 und GlyT2 aus der Synapse entfernt.](/312908/original-1572010259.jpg?t=eyJ3aWR0aCI6ODQ4LCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MzEyOTA4fQ%3D%3D--399ef533ff26c3718001809e72477f8498aca6a8)



![Verlust der Zn2+-induzierten Verstärkung glyzinerger Hemmung resultiert in einer erhöhten Schreckreaktion A: Pentameres Modell der extrazellulären Ligandenbindungsdomäne des GlyR (Aufsicht) [2]. Links: Bindung von Zn2+ (hellgrün) an der Schnittstelle von benachbarten Untereinheiten des GlyR führt zu einer Veränderung der Wechselwirkungen. Rechts: Verlust der Zink-Bindung nach Mutation der Bindungsstelle [10]. B: Phänotyp einer gesunden (links) und einer „hyperekplektischen“ (rechts) Maus mit mutierter GlyR-Zn2+-Bindungsstelle. Die verstärkte Schreckreaktion zeigt sich in einer Verspannung der Hinterbeine. C: Schema zur verstärkenden Funktion von Zn2+ an hemmenden Synapsen. Zn2+ ist essentiell für die Verstärkung der Glyzinrezeptorantwort (links). Die Bindung von Zink (rot) führt zum vermehrten Einstrom von Chloridionen und somit zu einer Verstärkung der hemmenden Wirkung von Glyzin (links, schwarze Pfeile). Mutation der Zinkbindungsstelle am GlyR verhindert die Zink-bedingte Verstärkung des Chlorideinstroms und bedingt in der genetisch veränderten Maus Symptome ähnlich der menschlichen Schreckerkrankung „Hyperekplexie“ (rechts) [11]. Verlust der Zn2+-induzierten Verstärkung glyzinerger Hemmung resultiert in einer erhöhten Schreckreaktion A: Pentameres Modell der extrazellulären Ligandenbindungsdomäne des GlyR (Aufsicht) [2]. Links: Bindung von Zn2+ (hellgrün) an der Schnittstelle von benachbarten Untereinheiten des GlyR führt zu einer Veränderung der Wechselwirkungen. Rechts: Verlust der Zink-Bindung nach Mutation der Bindungsstelle [10]. B: Phänotyp einer gesunden (links) und einer „hyperekplektischen“ (rechts) Maus mit mutierter GlyR-Zn2+-Bindungsstelle. Die verstärkte Schreckreaktion zeigt sich in einer Verspannung der Hinterbeine. C: Schema zur verstärkenden Funktion von Zn2+ an hemmenden Synapsen. Zn2+ ist essentiell für die Verstärkung der Glyzinrezeptorantwort (links). Die Bindung von Zink (rot) führt zum vermehrten Einstrom von Chloridionen und somit zu einer Verstärkung der hemmenden Wirkung von Glyzin (links, schwarze Pfeile). Mutation der Zinkbindungsstelle am GlyR verhindert die Zink-bedingte Verstärkung des Chlorideinstroms und bedingt in der genetisch veränderten Maus Symptome ähnlich der menschlichen Schreckerkrankung „Hyperekplexie“ (rechts) [11].](/313132/original-1572010258.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MzEzMTMyfQ%3D%3D--3409be560a384e8f523b904401d07ebb00575b2b)