Forschungsbericht 2014 - Max-Planck-Institut für terrestrische Mikrobiologie
Wie anaerobe Bakterien und Archaeen Energie konservieren
How anaerobic bacteria and archaea conserve energy
Buckel, Wolfgang
Max Planck Fellow; Mechanism of Enzymes from Anaerobic Bacteria
Die Biochemie der Energiegewinnung
Alle Organismen verbrauchen ständig chemische Energie in Form von ATP (Adenosintriphosphat), das dabei zu ADP (Adenosindiphosphat) und Phosphat hydrolysiert wird. Die umgekehrte Reaktion, die Synthese von ATP aus ADP und Phosphat, bezeichnet man in der Biologie als Energiekonservierung. In diesem Prozess werden Nahrungsstoffe wie Zucker und Aminosäuren mit NAD+ (Nicotinamid-Adenin-Dinukleotid) oxidiert, wobei NADH (die reduzierte Form von NAD+) und energiereiche Phosphatester gebildet werden, deren Phosphatrest auf ADP unter Bildung von ATP übertragen werden kann (Substratkettenphosphorylierung, SLP).
In aeroben Organismen wird NADH mit Sauerstoff in einer Reaktionskette, die an membranständigen Proteinkomplexen stattfindet, wieder zu NAD+ oxidiert und die dabei frei werdende Gibbs-Energie wird zum Aufbau eines elektrochemischen Ionengradienten (ΔµH+ oder ΔµNa+) zwischen der Innen und Außenseite der Membran genutzt, analog dem Laden einer Batterie. Bei phototrophen, von Licht lebenden Organismen wie Pflanzen und manchen Bakterien, wird ΔµH+ durch Lichtenergie gebildet. Die so geladenen Batterien treiben eine in der Membran sitzende elektrische ATP-Synthase an, die ATP aus ADP und Phosphat synthetisiert (Elektronentransport-Phosphorylierung, ETP).
Bei anaerob lebenden Bakterien und Archaeen übernehmen andere Elektronenakzeptoren wie Nitrat oder Sulfat die Rolle des Sauerstoffs. Fehlen diese, so werden organische Substrate nicht nur oxidiert, sondern auch reduziert; man spricht dann von Fermentationen oder Gärungen. Bis vor wenigen Jahren war man der Meinung, dass bei Fermentationen Energie nur über SLP konserviert wird. Allerdings zeigten thermodynamische Berechnungen, dass fermentierende Anaerobier die zur Verfügung stehende Gibbs-Energie mit SLP allein nur unvollständig nutzen können. Im Jahr 2008 wurde dann ein Mechanismus postuliert und verifiziert, mit dem fermentierende Anaerobier über ETP noch zusätzliche Energie konservieren und damit ebenso effizient wie die Aerobier arbeiten oder sie sogar in manchen Fällen noch übertreffen können. Bei dem Mechanismus handelt es sich um das Zusammenspiel der NADH-Ferredoxin-Oxidoreduktase, auch Rnf genannt, mit der Elektronenbifurkation auf Flavinbasis (flavin-based electron bifurcation, FBEB; [1]).
NADH-Ferredoxin-Oxidoreduktase
Clostridien sind strikt anaerobe Bakterien, die Kohlehydrate und Aminosäuren zu CO2, Acetat, kurzkettigen Fettsäuren, Ammonium und Wasserstoff fermentieren. Die Bildung von Wasserstoff erfordert das starke Reduktionsmittel Ferredoxin (Fd). Dies ist ein kleines Protein, bestehend aus 60 Aminosäuren und zwei Eisen-Schwefel-Clustern, [4Fe-4S]2+, die ein Elektron aufnehmen können. NADH ist ein schwächeres Reduktionsmittel und braucht deshalb Energie in Form von ΔµH+/Na+, um Ferredoxin zu reduzieren. Das dafür verantwortliche Membranenzym, eine NADH-Ferredoxin-Oxidoreduktase, wurde zuerst in Rhodobacter capsulatus entdeckt, wo es reduziertes Ferredoxin (Fd-) für die Stickstofffixierung zur Verfügung stellt. Deshalb wird das Enzym auch Rnf genannt (Rhodobacter nitrogen fixation). Der phototrophe R. capsulatus ist nicht energielimitiert und kann daher ΔµH+ zur Reduktion von Ferredoxin verbrauchen. Die energielimitierten Clostridien dagegen verwenden zur Energiekonservierung Rnf in umgekehrter Richtung, also zur ATP-Produktion [2] - womit sich die Frage stellt, wie Clostridien dazu in der Lage sind, Ferredoxin reduzieren.
Elektronenbifurkation bei der Buttersäure-Synthese
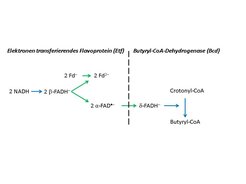
Clostridien produzieren Butyrat über die stark exergone Reduktion der Doppelbindung von Crotonyl-CoA zu Butyryl-CoA mit NADH (CoA: Coenzym A). Schon Fritz Lipmann, der „Vater der energiereichen" Bindung in der Biochemie, vermutete, dass diese Reduktion mit der Synthese von ATP gekoppelt sei, konnte aber keinen Mechanismus formulieren. Überraschenderweise besteht das gereinigte cytoplasmatische Enzym Butyryl-CoA-Dehydrogenase (Bcd) aus einem Komplex, der zusätzlich die beiden Untereinheiten eines Elektronen-transferierenden Flavoproteins (Etf) enthält. Das Flavin-Adenin-Dinukleotid (FAD)- und Adenosinmonophosphat (AMP)-haltige Etf ist von der β-Oxidation der Fettsäuren in Aerobiern bekannt. In Mitochondrien wiederum überträgt es die Elektronen einzeln von der Acyl-CoA-Dehydrogenase auf das Chinon der Atmungskette. Das Etf der Clostridien enthält statt des AMP noch ein zweites FAD (β-FAD), das mit NADH reduziert wird und ein Elektron auf das erste FAD (α-FAD), jedoch nicht weiter auf Crotonyl-CoA überträgt. So kam der Autor auf die Idee, dass die exergone Reduktion von Crotonyl-CoA mit NADH (negative Gibbs-Energie ΔG', Gleichung A) an die endergone Reduktion von Ferredoxin mit NADH (ΔG' positiv, Gleichung B) gekoppelt sein könnte [3].
(A) Crotonyl-CoA + NADH + H+→ Butyryl-CoA + NAD+; ΔG' = -52 kJ mol-1.
(B) 2 Fd + NADH→ 2 Fd- + NAD+ + H+; ΔG' = +42 kJ mol-1.
Diese Hypothese konnte kurz darauf zusammen mit der Arbeitsgruppe von Rolf K. Thauer (ebenfalls Max-Planck-Institut für terrestrische Mikrobiologie, Marburg) verifiziert werden [4]. Man bezeichnet diese Reaktion als Elektronen-Bifurkation (lat. furca = Gabel). Die beiden Elektronen des NADH spalten sich auf, wie die Zinken einer Gabel. Ein Elektron fließt zum energieärmeren positiveren Potenzial des Crotonyl-CoA, während das andere auf das energiereichere negativere Potenzial des Ferredoxins gehoben wird. Die Wiederholung dieses Vorgangs liefert das zweite Elektron zur Reduktion des Crotonyl-CoA zum Butyryl-CoA, wobei ein zweites Ferredoxin reduziert wird. Trotz der Kopplung der Crotonyl-CoA-Reduktion an die Ferredoxin-Reduktion ist die Gesamtreaktion unter physiologischen Bedingungen immer noch exergon (ΔG' = -52 + 42 = -10 kJ mol-1), so dass Ferredoxin vollständig reduziert wird.
Mechanismus der Flavin-basierten Elektronenbifurkation
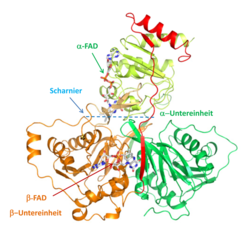
Um den Mechanismus der Elektronenbifurkation zu verstehen, wurde das rekombinante Etf aus Acidaminococcus fermentans kristallisiert und seine Struktur aufgeklärt (Abb. 1; [5]). In diesem strikt anaeroben Darmbakterium kommen Etf und Bcd als getrennte Proteine vor. Die Struktur des EtfAf gleicht dem des menschlichen EtfHo im verblüffenden Maß, enthält aber zwei FAD anstelle von FAD und AMP. Beide Etfs bestehen aus drei Domänen: Die α-Untereinheit bildet die Domänen I + II (grün und gelb in Abb. 2) und die β-Untereinheit bildet die Domäne III (braun). An der Oberfläche von Domäne II befindet in beiden Etfs das leicht zum Semichinon (FAD·-) reduzierbare α-FAD. Das β-FAD des EtfAf ist zwischen Domäne I und III eingebettet, während im EtfHo nur der AMP-Teil erhalten geblieben ist. In beiden Etfs befindet sich eine Scharnier-Region, die eine Bewegung der Domäne II hin zu den Domänen I+III erlaubt. Der C-Terminus der β-Untereinheit (rot in Abb. 1), der über die Domäne II reicht, verhindert wie ein Türstopper ein zu weites Umklappen. Dank dieses Scharniers können sich die 18 Å voneinander entfernten FADs ohne Beeinflussung der Tertiärstruktur auf 14 Å nähern und ein Elektron transferieren. Kristallisation von EtfAf mit NADH zeigte eine Lokalisation des Kofaktors neben dem β-FAD, sodass ein Hydridtransfer möglich ist. Modellierungen lassen erkennen, dass das tetramere Bcd neben dem α-FAD und das Ferredoxin neben dem β-FAD bindet.
Aus diesen Ergebnissen lässt sich folgender Mechanismus ableiten (Abb. 2): NADH überträgt ein Proton und zwei Elektronen auf das bifurkierende β-FAD. Das α-FAD greift sich ein Elektron des gebildeten β-FADH- und wird zum stabilen Semichinon reduziert, das das Elektron weiter auf das δ-FAD der Bcd überträgt. Das auf dem β-FADH· verbleibende hochreaktive Elektron ist nicht stabilisiert und kann so das nur 6 Å entfernte Ferredoxin reduzieren. In der folgenden Bifurkation erhält Bcd das zweite Elektron zur Reduktion von Crotonyl-CoA zu Butyryl-CoA, und gleichzeitig wird ein zweites Ferredoxin reduziert [5].
Elektronenbifurkationen in weiteren Energie konservierenden Stoffwechselwegen und am Ursprung des Lebens
Die Elektronenbifurkation ist nicht auf das Etf/Bcd-System beschränkt. Es sind bis jetzt sechs weitere Systeme bekannt, die alle Ferredoxin reduzieren und im Gegensatz zu Etf/Bcd noch mindestens ein Fe-S-Cluster enthalten [1]; drei Systeme seien hier erwähnt:
(i) In der Zelle findet sich neben NAD+ noch das phosphorylierte NADP+, das hauptsächlich als NADPH vorkommt und eine höhere Reduktionskraft als NADH aufweist. Damit NADPH neben NAD+ existieren kann, wird eine energieverbrauchende Transhydrogenase benötigt, die in Clostridien mit NADH und zwei Fd- zwei NADP+ reduziert. Diese umgekehrte Bifurkation bezeichnet man als Konfurkation, da hier die Kombination aus einem schwachen und einem starken Reduktionsmittel NADP+ reduziert [6].
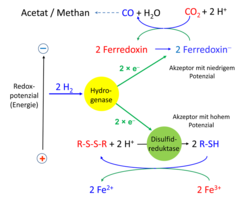
(ii) CO2 und Wasserstoff sind die Substrate für Methan bildende Archaeen und für Acetat bildende Bakterien. Da aber die Reduktionskraft des Wasserstoffs zur CO2-Reduktion nicht ausreicht, werden wieder Bifurkationen benötigt. Methanogene Archaeen reduzieren das für die Reduktion von CO2 zur Formylgruppe benötigte Ferredoxin über die Bifurkation mit Wasserstoff, wobei das Heterodisulfid als positiver Elektronenakzeptor dient. Heterodisulfid (CoM-S-S-CoB) entsteht als Endprodukt der Methanogenese bei der Reduktion von Methyl-S-Coenzym M mit HS-Coenzym B zu Methan. Diese Kopplung der ersten mit der letzten Reaktion der Methanogenese war schon lange als RPG-Effekt bekannt (nach seinem Entdecker Robert P. Gunsalus benannt) und fand jetzt durch die Formulierung der Bifurkation eine molekulare Erklärung [7].
(iii) Weit verbreitet ist eine Hydrogenase, die konfurkierend aus zwei NADH und vier Fd- vier H2 erzeugt. Beide Reduktionsmittel entstehen bei der Oxidation von Glucose zu zwei Acetat und zwei CO2 [8]. In acetogenen Bakterien liefert die gleiche Hydrogenase bifurkierend Fd-, um CO2 zu Kohlenmonoxid und Formiat, den beiden Bausteinen der Acetat-Synthese, zu reduzieren (Abb. 3; [9]). Bei der Entstehung des Lebens vor rund 3,8 Milliarden Jahren gab es vermutlich vulkanische Unterwasser-Schlote, in denen sich als biochemische Urreaktion aus CO2, Wasserstoff und Schwefelwasserstoff Acetylthioester gebildet haben könnten. Die dazu notwendige Bifurkation lief vielleicht über Molybdate, die wie Flavine und Chinone die drei dazu notwendigen Oxidationsstufen (Mo IV, V und VI) ausbilden können [10].
Danksagung
Der Autor dankt Professor Dr. R. K. Thauer, Max-Planck-Institut für terrestrische Mikrobiologie, für hilfreiche Diskussionen. Dieser Bericht basiert zum Teil auf einer Veröffentlichung im Biospektrum, die mit Erlaubnis des Verlags verwendet wurde.


