Forschungsbericht 2004 - Max-Planck-Institut für molekulare Biomedizin
Endothelzellen: Barriere zwischen Blut und Gewebe
Endothelial Cells: Barrier between Blood and Tissue
Vaskuläre Zellbiologie (Vestweber) (Prof. Dr. Dietmar Vestweber)
MPI für molekulare Biomedizin, Münster
Einleitung
Endothelzellen bilden die innerste Zellschicht der Blutgefäße. Dadurch kommen sie direkt mit Leukozyten, den Abwehrzellen des Blutes, in Kontakt und bestimmen darüber, wann und wo Leukozyten das System der Blutgefäße verlassen können, um in Infektions- und Entzündungsherde einzudringen. Auf Grund der extrem schnellen Vermehrungsgeschwindigkeit von Mikroorganismen ist es überlebenswichtig, dass schon kleinste Infektionsherde unverzüglich von den Blutzellen erkannt werden. Die Abwehrzellen müssen im schnell strömenden Blut aus dem intakten Blutgefäß heraus innerhalb von Sekunden erkennen, dass sie sich durch infiziertes Gewebe bewegen. Dieses Erkennen wird durch Proteine vermittelt, die in entzündetem Gewebe auf der Oberfläche von Endothelzellen induziert werden. Leukozyten erkennen diese Proteine und sind in der Lage, an ihnen Halt zu finden. Während in den letzten Jahren die Mechanismen der kontrollierten Anheftung von Leukozyten an die Endotheloberfläche in Entzündungsherden intensiv untersucht wurden und im Prinzip verstanden sind, ist sehr wenig über den Prozess des Hindurchwanderns von Leukozyten durch die Endothelbarriere (Diapedese) und die darunterliegende Basalmembran bekannt. Eines der Hauptziele der Arbeitsgruppe um Dietmar Vestweber ist es zurzeit, diesen Prozess zu verstehen. Den Arbeiten liegt die Hypothese zu Grunde, dass Endothelzellkontakte während des Prozesses der Diapedese, induziert durch das Andocken der Leukozyten, kontrolliert geöffnet und wieder geschlossen werden. Die gezielte Suche nach molekularen Mechanismen, die die Öffnung und Formierung von Endothelzellkontakten beeinflussen, hat zur Identifizierung von Proteinen geführt, die auch für einen anderen Prozess – den der Bildung von Blutgefäßen (Angiogenese) – von Bedeutung sind.
Adhäsionsmechanismen an Endothelzellkontakten und Diapedese
Der wohl wichtigste Adhäsionsmechanismus für die Stabilität von Endothelzellkontakten wird durch das endothelspezifische Mitglied der Familie der Cadherine gebildet: VE-cadherin. Antikörper gegen VE-cadherin können die Zellkontakte zwischen Endothelzellen sowohl in vitro als auch in vivo dissoziieren. Dies führt in vivo zu beschleunigter Einwanderung von Leukozyten in entzündete Gewebe. Das bedeutet, dass VE-Cadherin-vermittelte endotheliale Zellkontakte eine Barriere für extravasierende (ins Gewebe austretende) Leukozyten darstellen. Molekulare Mechanismen, die die Funktion oder Expression von VE-cadherin beeinflussen, würden also wahrscheinlich auch die Extravasation von Leukozyten regulieren können. Mit einer endothelspezifisch exprimierten Phosphatase (VE-PTP), die wie ein Rezeptormolekül auf der Zelloberfläche exprimiert wird, wurde kürzlich ein möglicher Regulator von VE-cadherin entdeckt, der mit VE-cadherin in regulierter Form assoziieren kann und der die Adhäsionsfunktion von VE-cadherin in transfizierten Zellen verbessert. Zurzeit wird die Bedeutung dieser Assoziation in Endothelzellen überprüft.
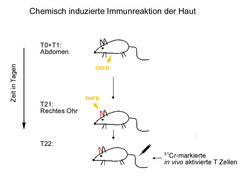
Ein neuer Adhäsionsmechanismus an Endothelzellkontakten wurde für das relativ kleine, stark glykosylierte CD99 etabliert. Dieses Protein ist schon seit geraumer Zeit auf allen menschlichen Leukozyten beschrieben worden. Es gelang erstmals, das bisher nicht beschriebene Maus-Homologe zu CD99 zu identifizieren. Auch dieses Protein ist auf Leukozyten und Endothelien zu finden. Mithilfe von Antikörpern gelang den Wissenschaftlern in Münster der Nachweis, dass dieses Molekül in vivo an der Einwanderung von Lymphozyten in entzündetes Gewebe beteiligt ist (Abb. 1 und Abb. 2). Da CD99 in transfizierten Zellen homotypische Zellbindung vermitteln kann, ist es denkbar, dass CD99 direkt an der Bildung des Kontakts zwischen Leukozyt und Endothelzelle während der Diapedese beteiligt ist. Interessanterweise war die direkte Adhäsion der Lymphozyten an die apikale Oberfläche von Endothelien unabhängig von CD99. Es ist auch denkbar, dass CD99 indirekt andere Adhäsionsmechanismen an Endothelzellkontakten beeinflusst.
Ein drittes Protein, das in der Arbeitsgruppe kürzlich identifiziert wurde, ist das nur auf Endothelien und Thrombozyten exprimierte ESAM („endothelial cell selective adhesion molecule“). ESAM ist ein Mitglied der Immunglobulin-Supergenfamile (Ig-SF). Innerhalb dieser sehr großen Genfamilie gehört ESAM zu einer Unterfamilie von Proteinen mit zwei extrazellulären Ig-Domänen, zu denen auch die drei "junctional adhesion molecules" (JAMs) gehören, von denen zumindest zwei auf noch unbekannte Weise eine Rolle spielen bei der Extravasation von Leukozyten. Zumindest eines der drei JAMs ist in "tight junctions" von Epithelien assoziiert. ESAM wurde ebenfalls selektiv an tight junctions von Endothelzellen lokalisiert.
Tight junctions sind vor allem in Epithelien gut untersuchte Membrankontakte, die einerseits Zellschichten parazellulär abdichten und andererseits eine Barriere innerhalb der zellulären Plasmamembran darstellen, die die apikale von der baso-lateralen Domäne der Zelloberfläche abgrenzt und damit für die Polarisierung von Zellen essentiell ist. Mit den JAMs und den mit ihnen verwandten Proteinen ist eine neue Klasse von Proteinen entdeckt worden, die sehr interessante, aber im Detail noch nicht verstandene regulative Funktionen an tight junctions wahrnehmen. Im Gegensatz zur Familie der vier Transmembran-Domänen enthaltenen Claudins haben die JAM-artigen Proteine keine direkt strukturbildende Funktion (Claudins können allein ausreichen, um in transfizierten Zellen Tight-junction-Strukturen zu bilden). Nach ersten Ergebnissen in der Arbeitsgruppe scheint es, als ob ESAM wesentliche regulatorische Funktionen an tight junctions wahrnimmt. Ersten Hinweisen zufolge konnte gezeigt werden, dass ESAM bei der Extravasation von neutrophilen Granulozyten in vivo eine Rolle spielt.
![CD99 vermittelt die Einwanderung von Lymphozyten in entzündete Areale der Haut in der Maus. Nach wiederholter Stimulierung der Haut durch ein chemisches Reagenz (siehe Abb. 1) kommt es zur Einwanderung von radioaktiv markierten Lymphozyten, die das Reagenz spezifisch erkennen. Während die Einwanderung von Lymphozyten in nicht-stimulierte Haut vernachlässigbar ist (nicht-entzündet), ist eine deutliche Einwanderung zu beobachten, wenn Kontroll-Antikörper (co-IgG) oder Antikörper gegen ein Kontrollantigen (anti-ESAM) injiziert wurden. Antikörper gegen CD99 (anti-CD99) hingegen können die Einwanderung zum größten Teil inhibieren. Diese Ergebnisse wurden in der Fachzeitschrift Blood publiziert [1]; © the American Society of Hematology.](/865210/original-1294357533.jpg?t=eyJ3aWR0aCI6MjQ2LCJvYmpfaWQiOjg2NTIxMH0%3D--d4a7b626fde19f17cdb0a9f1c56881d03f1c714f)
Adhäsionsmechanismen an Endothelzellkontakten und Angiogenese
Bereits vor zwei Jahren wurde von zwei unterschiedlichen Arbeitsgruppen gezeigt, dass VE-cadherin essentiell ist für die Blutgefäßbildung des Mausembryos. ZuzZeit wird analysiert, ob auch die mit VE-cadherin assoziierende Phosphatase VE-PTP am Prozess der Angiogenese beteiligt ist.
Um Regulationsmechanismen dieses wichtigen endothelialen Adhäsionsmoleküls besser verstehen zu können, suchten die Wissenschaftler um Dietmar Vestweber in einem molekulargenetisch/biochemischen Ansatz nach weiteren mit VE-cadherin assoziierten Proteinen. Auf diese Weise wurde eine intrazelluläre Kinase, Csk, gefunden, die an einen bestimmten Tyrosinrest des cytoplasmatischen Teils von VE-cadherin bindet, sobald dieser in phosphorylierter Form vorliegt. Trotz intensiver Bemühungen war es nicht möglich nachzuweisen, dass die Bindung von Csk an VE-cadherin die Adhäsionsfunktion beeinflusst. In weiteren Untersuchungen stellte sich jedoch heraus, dass die Bindung von Csk an VE-cadherin in transfizierten Zellen offensichtlich die Proliferation dieser Zellen beeinflusst. Es ist bereits seit längerem bekannt, dass Cadherine anti-proliferativ wirken können, und es wird vermutet, dass Cadherine den Stopp des Zellwachstums in konfluenten Zellverbänden vermitteln. Die neuen Resultate zu Csk legen den Schluss nahe, dass die Interaktion von Csk mit VE-cadherin in diesen Prozess involviert ist.
Auch für das kürzlich entdeckte ESAM wurde eine Rolle in der Angiogenese beschrieben. Obwohl es offensichtlich nicht essentiell ist für die Bildung embryonaler Blutgefäße, denn ESAM-gendefiziente Mäuse weisen keinerlei Fehlbildungen auf, so scheint es doch in der Tumorangiogenese eine Rolle zu spielen. Eine generelle Beteiligung am Prozess der adulten Angiogenese wird derzeit analysiert.
Zu der Familie der JAM-artigen Proteine gehört auch ein Protein, das als Coxsackievirus-Adenovirus-Rezeptor bekannt ist, und das das zu ESAM strukturell nächst verwandte Mitglied dieser Familie darstellt. Seine physiologische Bedeutung ist noch weitgehend unklar. Es ist in Epithelien mit tight junctions assoziiert. Außerdem wurde es auf kultivierten Endothelzellen beschrieben und embryonal auf Kardiomyozyten und neuronalen Zellen gefunden. Basierend auf der Hypothese, dass es eine wichtige Funktion im vaskulären System spielen könnte, wurden gendefiziente Mäuse untersucht. Es stellte sich in der Tat heraus, dass CAR -/--Mäuse embryonal letal waren. Allerdings ließ sich wider Erwarten keinerlei Expression von CAR auf Endothelien von gesunden Mausembryonen nachweisen. Die zur Letalität führenden embryonalen Defekte waren demzufolge auch nicht direkt auf Defekte des vaskulären Systems zurückzuführen, obwohl Dilatationen größerer Gefäße beobachtet wurden. Diese Fehlbildungen sind aber sehr wahrscheinlich auf indirekte Effekte, ausgelöst durch Fehlfunktionen des Herzens, zurückzuführen. Die Wissenschaftler konnten zeigen, dass der primäre Defekt auf eine fehlerhafte Organisation der Myofibrillen in Kardiomyozyten zurückzuführen war. Vor allem war auffallend, dass die Kontinuität der Organisation von Myofibrillenbündeln über den Zellkontakt zwischen Kardiomyozyten (intercalated disk) hinaus gestört war (Abb. 3).
![Kultivierte embryonale Kardiomyozyten von Wildtyp (CAR+/+) und CAR-defizienten (CAR-/-)-Mäusen. Zwei Antigene sind mit verschiedenen Farben markiert. N-cadherin (grün) markiert den Zellkontakt der Zellen und α-actinin (rot) markiert die Myofibrillen. Es ist deutlich zu sehen, dass die Kontinuität der Orientierung der Myofibrillen über den Zellkontakt hinaus nur in Wildtyp-Zellen, nicht jedoch in CAR-defizienten Zellen zu beobachten ist. Dieses Ergebnis wurde im Journal of Cell Science publiziert [2].](/865266/original-1294357350.jpg?t=eyJ3aWR0aCI6MjQ2LCJvYmpfaWQiOjg2NTI2Nn0%3D--f46153fd8e148e52eee59ad3f12a884eb049dc29)
Damit ist erstmals gezeigt, dass ein Mitglied der JAM-artigen Proteine eine wesentliche Rolle spielt bei der Organisation zytoskeletaler Strukturen. Im Licht dieser Ergebnisse ist es interessant, dass CAR zwar auf Kardiomyozyten im erwachsenen gesunden Herzen nicht mehr exprimiert wird, dass es jedoch bei Kardiomyopathien im menschlichen Herzen stark induziert wird. Die weitere Untersuchung dieser interessanten Funktion von CAR verspricht sowohl zellbiologisch als auch medizinisch interessant zu sein.

![CD99 vermittelt die Einwanderung von Lymphozyten in entzündete Areale der Haut in der Maus. Nach wiederholter Stimulierung der Haut durch ein chemisches Reagenz (siehe Abb. 1) kommt es zur Einwanderung von radioaktiv markierten Lymphozyten, die das Reagenz spezifisch erkennen. Während die Einwanderung von Lymphozyten in nicht-stimulierte Haut vernachlässigbar ist (nicht-entzündet), ist eine deutliche Einwanderung zu beobachten, wenn Kontroll-Antikörper (co-IgG) oder Antikörper gegen ein Kontrollantigen (anti-ESAM) injiziert wurden. Antikörper gegen CD99 (anti-CD99) hingegen können die Einwanderung zum größten Teil inhibieren. Diese Ergebnisse wurden in der Fachzeitschrift Blood publiziert [1]; © the American Society of Hematology. CD99 vermittelt die Einwanderung von Lymphozyten in entzündete Areale der Haut in der Maus. Nach wiederholter Stimulierung der Haut durch ein chemisches Reagenz (siehe Abb. 1) kommt es zur Einwanderung von radioaktiv markierten Lymphozyten, die das Reagenz spezifisch erkennen. Während die Einwanderung von Lymphozyten in nicht-stimulierte Haut vernachlässigbar ist (nicht-entzündet), ist eine deutliche Einwanderung zu beobachten, wenn Kontroll-Antikörper (co-IgG) oder Antikörper gegen ein Kontrollantigen (anti-ESAM) injiziert wurden. Antikörper gegen CD99 (anti-CD99) hingegen können die Einwanderung zum größten Teil inhibieren. Diese Ergebnisse wurden in der Fachzeitschrift Blood publiziert [1]; © the American Society of Hematology.](/865210/original-1294357533.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6ODY1MjEwfQ%3D%3D--7438fa509ac58541c97a62752eaa976a0c0276fe)
![Kultivierte embryonale Kardiomyozyten von Wildtyp (CAR+/+) und CAR-defizienten (CAR-/-)-Mäusen. Zwei Antigene sind mit verschiedenen Farben markiert. N-cadherin (grün) markiert den Zellkontakt der Zellen und α-actinin (rot) markiert die Myofibrillen. Es ist deutlich zu sehen, dass die Kontinuität der Orientierung der Myofibrillen über den Zellkontakt hinaus nur in Wildtyp-Zellen, nicht jedoch in CAR-defizienten Zellen zu beobachten ist. Dieses Ergebnis wurde im Journal of Cell Science publiziert [2]. Kultivierte embryonale Kardiomyozyten von Wildtyp (CAR+/+) und CAR-defizienten (CAR-/-)-Mäusen. Zwei Antigene sind mit verschiedenen Farben markiert. N-cadherin (grün) markiert den Zellkontakt der Zellen und α-actinin (rot) markiert die Myofibrillen. Es ist deutlich zu sehen, dass die Kontinuität der Orientierung der Myofibrillen über den Zellkontakt hinaus nur in Wildtyp-Zellen, nicht jedoch in CAR-defizienten Zellen zu beobachten ist. Dieses Ergebnis wurde im Journal of Cell Science publiziert [2].](/865266/original-1294357350.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6ODY1MjY2fQ%3D%3D--2a81c3e3005793d226e8888425fa30d532e58683)