Forschungsbericht 2018 - Max-Planck-Institut für medizinische Forschung
Dank Protein-Engineering ist das Analyselabor stets griffbereit
Protein engineering brings the clinical laboratory to the patient´s fingertip
Einleitung
Krankheiten oder Verletzungen führen häufig zu charakteristischen Änderungen der Blutkonzentration von Metaboliten. Beispielsweise sind erhöhte Konzentrationen der Aminosäure Phenylalanin typisch für die Erbkrankheit Phenylketonurie, eine der häufigsten angeborenen Stoffwechselstörungen. Bei Kleinkindern, die an dieser Erkrankung leiden, muss der Phenylalanin-Wert im Blut durch eine strenge Diät kontrolliert werden, um irreversible Entwicklungsschäden zu vermeiden. Aus diesem Grund ist die regelmäßige Messung der Phenylalanin-Konzentration im Blut der betroffenen Patienten unerlässlich. Gegenwärtig müssen für diese Kontrollen Blutproben beim Arzt abgenommen, in ein Labor eingesandt und dort analysiert werden. Dieses Verfahren dauert meist Tage, und der Verzug zwischen Probenentnahme und Erhalt des Ergebnisses erschwert die Behandlung für Patienten und Ärzte gleichermaßen. Um hier Abhilfe zu schaffen, hat unser Forscherteam eine einfache, papierbasierte und minutenschnelle Methode zur Bestimmung der Konzentration von Metaboliten wie Phenylalanin entwickelt. Diese neue Analysemethode wurde bereits in Zusammenarbeit mit Wissenschaftlern der Universitätskliniken Heidelberg und Lausanne an Patientenproben validiert. Unsere Arbeit ist ein wichtiger Schritt in der Entwicklung eines patientennahen Schnelltestverfahrens zur Konzentrationsbestimmung von Metaboliten in Blutproben.
Molekulares Engineering

Abb. 1: Die Farbe des vom Biosensor ausgestrahlten Lichtes ändert sich in Anwesenheit (links) und Abwesenheit (rechts) des Kofaktors NADPH. Für diese Aufnahme wurde der Biosensor in einer wässrigen Lösung in ein Plastikröhrchen pipettiert.
Gegenwärtig werden Metaboliten oder andere Biomarker in Blutproben meist durch herkömmliche Labormethoden oder deren miniaturisierte Versionen quantifiziert. Unser Ansatz hingegen beruht auf einem neuartigen molekularen Werkzeug, einem sogenannten semisynthetischen Biosensor. Dieser Sensor besteht aus zwei Komponenten: einem multifunktionalen Protein und einem synthetischen Farbstoff, der an das Protein gekoppelt wird. Durch diese Kombination entsteht ein lumineszenter Biosensor, der seine Farbe in Anwesenheit des Kofaktors Nikotinamidadenindinukleotid (kurz: NADPH) verändert. Diese Farbänderung lässt sich mit dem bloßen Auge oder einer einfachen Kamera wahrnehmen (Abb. 1) und kann damit indirekt zur Quantifizierung einer Vielzahl von Metaboliten genutzt werden. Dabei werden die Metaboliten zunächst in spezifischen, enzymatisch katalysierten Reaktionen umgesetzt, bei denen NADPH gebildet wird. Das entstehende NADPH ist direkt proportional zur Konzentration des Metaboliten. Wir konnten bereits zeigen, dass unser Sensor im Labor für die Bestimmung der Plasmakonzentrationen von Phenylalanin, Glutamat und Glukose eingesetzt werden kann, indem verschiedene enzymatisch katalysierte Reaktionen genutzt werden.
Nutzung des Sensors für die Messung von Phenylalanin
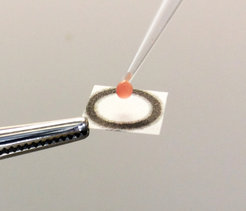
Abb. 2: Ein Gemisch aus Patientenblut und Reaktionspuffer wird auf ein mit dem Biosensor imprägniertes Papier aufgetragen. Die Farbe des ausgestrahlten Lichts wird anschließend über eine Kamera aufgenommen und ausgewertet.
Wie lässt sich dieser Biosensor nun zur patientennahen Bestimmung der Blutkonzentration von Phenylalanin einsetzen? Zuerst wird dem Patienten ein kleiner Tropfen Blut durch einen Stich in den Finger abgenommen. Anschließend wird ein Bruchteil dieser Probe mit einem Reaktionspuffer verdünnt, wo das Phenylalanin durch eine enzymkatalysierte Reaktion unter Bildung von NADPH umgesetzt wird. Die Probe wird dann auf einen Teststreifen mit dem getrockneten Biosensor aufgetragen (Abb. 2). Der Biosensor beginnt Licht auszustrahlen, welches von einer Digitalkamera oder einem Smartphone aufgezeichnet wird. Die NADPH-Konzentration, die durch die Intensität des ausgestrahlten Lichts bestimmt wird, korreliert direkt mit der Phenylalanin-Konzentration im Blut. Das gesamte Verfahren dauert nur ca. 10 bis 15 Minuten und kann mit einfachen Hilfsmitteln direkt beim Patienten vor Ort durchgeführt werden. Die Genauigkeit der Ergebnisse ist vergleichbar mit der Genauigkeit moderner Standardmethoden in klinischen Laboren.
Ausblick
Die schnelle und einfache Handhabung sowie die Genauigkeit des Sensors sollten es Patienten zukünftig erlauben, Kontrollmessungen auch selbst durchzuführen. Hierfür muss das Verfahren weiter vereinfacht, automatisiert und validiert werden. Die Aussicht, betroffenen Patienten ein solch neuartiges Hilfsmittel zur Verfügung zu stellen, ist eine besondere Motivation, diese Herausforderungen zu meistern. Die Arbeit unterstreicht weiterhin, wie die Synergie zwischen synthetischer Chemie und Protein-Engineering genutzt werden kann, um semisynthetische Biomoleküle mit neuartigen Eigenschaften zu erzeugen.

