Forschungsbericht 2007 - Max-Planck-Institut für Dynamik komplexer technischer Systeme
Grippe Impfstoffherstellung in Einweg-Bioreaktoren
Grippe Impfstoffe, Politik & Pandemiepläne
Das Thema Grippe, speziell Vogelgrippe, hat die Medien und Öffentlichkeit in den letzten Jahren immer wieder beschäftigt. Die Angst vor einer möglichen Pandemie flammt kurzzeitig auf, um dann wieder durch andere Themen in den Hintergrund gedrängt zu werden. Aber neben den saisonalen Influenza-Epidemien bleibt das Risiko einer Pandemie eine ständige Bedrohung und viele Wissenschaftler in Forschung und Industrie sind bestrebt, adäquat für den Ernstfall vorbereitet zu sein. Daher sind in den letzten Jahren vor allem in den USA öffentliche Gelder vergeben worden, um alternative Produktionssysteme zu der klassischen Vermehrung der Viren in Hühnereiern zu fördern. Inzwischen haben die meisten Impfstoffhersteller eine zweite Produktionsschiene mit Säugerzellen entwickelt und neue Anlagen zur Produktion von Influenza-Impfstoffen in Bioreaktoren wurden in Betrieb genommen. Analog zu dem klassischen Prozess mit Hühnereiern werden Grippeviren in Säugerzellen vermehrt, die freigesetzten Viren als Lebendimpfstoff (mit abgeschwächten Viren) oder als inaktivierte Viren aus der Kulturbrühe aufgereinigt und zum Endprodukt weiterverarbeitet. Die Entwicklung alternativer Methoden, wie die Produktion der Virushülle oder einzelner Virusproteine in Insektenzellen, Bakterien oder Hefen wird ebenfalls intensiv verfolgt. Daneben ist die Herstellung von antiviralen Medikamenten zur aktiven Bekämpfung einer Grippe, wie Tamiflu, auch weiterhin aktuell. So hofft man, nicht nur für einen kleinen Teil der Weltbevölkerung eine Abwehr gegen Influenzaviren zu haben.
Gegenüber anderen biotechnologischen Produkten gelten bei der Entwicklung von Herstellungsverfahren für Impfstoffe besondere Anforderungen:
- das Produkt ist für einen gesunden Patient bestimmt und Nebenwirkungen werden nicht akzeptiert
- gesunde Patienten sehen zunächst keine Notwendigkeit für eine Behandlung (Impfmüdigkeit)
- das Produkt ist ein Massenprodukt und muss billig, stabil (Lagerung) und einfach zu verabreichen sein
- bei einem Impfstoff wie Influenza muss die Produktion sehr flexibel sein, da jedes Jahr andere Viren mit leicht anderen Charakteristika hergestellt werden müssen
- im Falle einer Pandemie muss in kürzester Zeit sehr viel Produkt hergestellt werden.
Informationen über die jeweiligen Herstellungsprozesse und deren Weiterentwicklung wurden von den Unternehmen in der Regel sehr vertraulich behandelt. Dies hat sich durch die öffentliche Diskussion der Thematik „Bedrohung durch Infektionskrankheiten“ in den letzten Jahren zumindest zum Teil geändert. Projekte, gefördert von der „Bill und Melinda Gates Foundation“ wie zum Beispiel die „International Aids Vaccine Initiative“ (IAVI), haben Impfstoffhersteller und Forschungseinrichtungen zu gemeinsamen Projekten zum Wissensaustausch bewegt und man hat in den letzten Jahren viele weitere interessante Entwicklungen sehen können (u.a. Public Private Partnerships). So wurden neue Zelllinien entwickelt (Designerzellen) und neue Reaktoren und Aufreinigungsverfahren getestet (Einweg-Bioreaktoren und Einweg-Aufreinigungseinheiten).
Welche Zellen produzieren unter welchen Bedingungen die meisten Viren?
Die Produktion von Grippeviren in bebrüteten Hühnereiern wurde vor vielen Jahren zugelassen und hat sich auch als sicher erwiesen. Der Impfstoff enthält allerdings sehr geringe Restmengen von Eierproteinen, die zu Allergien führen können. Bei der Produktion von Vogelgrippe-Viren stößt man mit diesem Produktionssystem natürlich auch auf Grenzen. Will man nun andere tierische Zellen zur Virusproduktion nutzen, so können diese nur unter bestimmten Bedingungen zugelassen werden. Die Zellen müssen z.B. frei von adventiven Agenzien sein (also frei von bekannten biologisch kontaminierenden Agenzien wie Mykoplasmen, Viren, Bakteriophagen) und es muss gezeigt werden, dass von dem hergestellten Impfstoff kein Risiko bezüglich Krebs oder Prionen hervorgeht.
So können CHO- oder BHK-Zellen nicht genutzt werden - beides Zellen, die häufig für die biotechnologische Herstellung rekombinanter Proteine oder monoklonaler Antikörper verwendet werden. Zu den für die Produktion von Humanimpfstoffen zugelassenen Zelllinien gehören zum Beispiel MDCK-, Vero- und Per.C6- Zellen. Dabei sind MDCK- und Vero-Zellen in der Regel adhärent, also auf Oberflächen wachsende Zellen von Hund bzw. grünen Meerkatzen, die ursprünglich aus Nierengewebe gewonnen wurden. Die humane Zelllinie Per.C6 gehört zu den so genannten „Designerzellen“, wächst in Suspension und wurde aus primären Retinoblasten durch Transfektion mit einem E1- Minigen aus Adenovirus Typ 5 gewonnen.
Welche dieser Zellen nun die beste Zelle für die Etablierung eines bestimmten Impfstoffprozesses ist, hängt von vielen verschiedenen Parametern ab. Wachstumsmedium und –bedingungen beeinflussen die maximal mögliche Zellzahl und somit die Virusausbeute. Das Medium während der Virusvermehrung sowie die Infektionsbedingungen beeinflussen dann die Produktivität der Zellen. Die Viren müssen an die Zellen adaptiert werden und der richtige Infektionszeitpunkt sowie das optimale Impfverhältnis Virus pro Zelle ermittelt werden. Fehlende Nährstoffe im Medium oder während des Prozesses akkumulierende, inhibitorische Substanzen haben ebenso einen großen Einfluss auf die Virusausbeute.
Die Arbeitsgruppe ,Upstream Processing’ der Fachgruppe Bioprozesstechnik am Max-Planck-Institut für Dynamik komplexer technischer Systeme hat sich intensiv mit der Influenza- Impfstoffherstellung in tierischen Zellen auseinander gesetzt und dazu auf verschiedenen Ebenen (extra- & intrazelluläre Metabolite, Wirtszellproteinantwort, Zellphysiologie, …) Analytikmethoden etabliert. Dabei wurden MDCK und Vero-Zellen unter verschiedenen prozessrelevanten Bedingungen verglichen. Durch die umfassende Analytik konnten zahlreiche Parameter, die Zellwachstum und Virusausbeute entscheidend beeinflussen, identifiziert und hinsichtlich ihres Einflusses auf den Gesamtprozess genauer charakterisiert werden [1-2]. Daten zum Verbrauch von Mediumsbestandteilen (Zucker, Aminosäuren, Sauerstoff), Zellzyklus, Zellwachstum sowie Absterben und Infektionsgrad, Virusausbeute (aktiv und inaktiv), programmierter Zelltod (Apoptose), Glykosylierungsmuster des Virusproteins Hämaglutinin oder die Proteinantwort der Wirtszellen stehen nun zur Verfügung und werden zur Klärung von Fragestellungen hinsichtlich Prozessentwurf und -optimierung weiter genutzt.
Bei optimaler Prozessführung scheinen sich die Ausbeuten der verschiedenen Zellen letztendlich nicht so sehr zu unterscheiden. Wichtiger ist es eher, nun mehrere Möglichkeiten zur Virusproduktion zu besitzen, Vor- und Nachteile der jeweiligen Systeme besser zu verstehen und im Falle einer Pandemie flexibel auf diese zurückgreifen zu können.
Einweg-Bioreaktoren – neue Möglichkeiten für schnelles und einfaches Produzieren?
Vor einigen Jahren wurde die bestehende Bioreaktortechnik überdacht. Anstelle von Edelstahl- oder Glas-Rührkesseln als Standardreaktor wurden Kultivierungsbeutel aus Polyethylen, ähnlich zu Bluttransfusionsbeuteln, vorgestellt. Diese werden auf einer beheizbaren Platte hin- und herbewegt, bei Bedarf begast und nach einmaligem Gebrauch entsorgt[3], siehe Abbildung 1.

Zunächst war eine Anwendung in der Gentherapie angedacht, wobei zu behandelndes Patientenmaterial in jeweils einen eigenen sterilen, zertifizierten Beutel überführt und anschließend wieder zurück in den Patienten gebracht werden sollte. Interessant könnten diese Reaktorsysteme auch für die Produktion von teuren Produkten aus der Zellkultur zum Beispiel mit kleinem Produktvolumen und häufig wechselnder Produktpalette sein. Denn dabei könnten lange Standzeiten durch Reinigung und Sterilisation und die bei Edelstahl-Rührkesseln notwendige, aber aufwendige Zulassungsprozedur umgangen werden.
Heute haben sich diese Reaktoren in vielen biotechnologischen und pharmazeutischen Prozessen durchgesetzt und werden in Maßstäben von 0,5 bis 500 L Arbeitsvolumen genutzt. Der Gedanke des Einweg-Bioreaktors wurde zudem weiterentwickelt und so sind nun weitere Reaktortypen bis hin zum Einweg-Rührkessel auf dem Markt. Die Medienvorlagebehälter sind inzwischen ebenso meist Einwegbeutel und auch in der Aufarbeitung (zum Beispiel bei Klärung und Konzentrierung, aber auch beim Einsatz chromatographischer Verfahren) werden mehr und mehr Einwegsysteme entwickelt. Der Grundgedanke dabei ist die zukünftige Entwicklung kompletter „plug-and-play“ Einweg-Produktionsanlagen. Noch ist man hinsichtlich des Maßstabs möglicher Prozesse begrenzt und bestehende Edelstahl-Anlagen werden sicher nicht ersetzt. Auch ist das zur Herstellung der Beutel verwendete Polyethylen nicht so innert wie Edelstahl. Damit könnten bei langen Prozesszeiten bei ungeeigneten Flüssigkeiten bzw. Medien Plastikbestandteile oder Weichmacher in das Produkt gelangen bzw. Mediumsbestandteile oder Produkte unspezifisch an die Beuteloberfläche binden und so nicht zur Verfügung stehen.
Die Arbeitsgruppe ,Upstream Processing’ hat nun diesen neuen Reaktortypen für die Produktion von Grippeviren genutzt und mittels der bestehenden umfassenden Analytik der Arbeitsgruppe einen Vergleich zum klassischen Rührkessel durchgeführt [4].
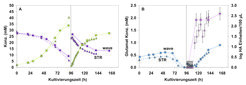
Es konnte gezeigt werden, dass der Einweg-Bioreaktor in seiner simpelsten Konstellation ohne pH- oder Sauerstoffregelung als „plug-and-play“ System zur Herstellung von Impfstoffen nutzbar ist. Zudem wurde die Möglichkeit gezeigt, adhärente Zellen auf Mikrocarriern in diesem Reaktorsystem zu kultivieren. Es wurden zunächst Mikrocarrierkonzentrationen von 2 und 4 g/L genutzt und dabei sogar höhere Zellzahlen als im Rührkessel erreicht (350 MDCK Zellen/Mikrocarrier gegenüber 250 MDCK Zellen/Mikrocarrier). Für die wichtigsten Metabolite (Glukose/Laktat, Glutamin/Ammonium, Glutamat) wurden ähnliche Verläufe gefunden wie im geregelten Rührkessel (Abb. 2A). Insbesondere wurden in beiden Reaktorsystemen vergleichbare Virusausbeuten erreicht (Abb. 2B). Letztendlich konnte der Prozess sowohl in serum-haltigem als auch in serum-freiem Medium erfolgreich durchgeführt werden, für MDCK als auch für Vero-Zellen in 1 und 10 L Arbeitsvolumen.
Für einen anderen Impfstoffprozess (Nerz Enteritis Virus) konnte in Zusammenarbeit mit IDT Biologika GmbH gezeigt werden, dass durch die Nutzung dieser Einwegreaktoren die Ausbeute des bestehenden Prozesses verbessert und - durch Wegfall der bisherigen zeit- und personalintensiven Herstellung in Rollerflaschen - erheblich vereinfacht werden kann [5]. Welche Scherkräfte bei der Wellenbewegung des Mediums in diesen Einwegreaktoren auf die Zellen wirken und warum mehr Zellen auf einem Mikrocarrier Platz haben als im Rührkessel wird momentan in Kooperation mit dem Lehrstuhl für Strömungsmechanik und Strömungstechnik der Otto-von-Guerricke Universität Magdeburg mittels Modelle für die Flüssigkeitsdynamik - „computational fluid dynamics“ (CFD) - untersucht.
Zusammengefasst bleibt festzustellen, dass Einweg-Bioreaktorsysteme in ihrer einfachsten Konstellation (ohne pH- und Sauerstoffregelung) eine Influenza-Impfstoffherstellung in einem Maßstab bis zu 500 L pro Reaktor ermöglichen. Dies könnte im Falle einer Pandemie mit einem schnellen Bedarf an großen Produktionskapazitäten eine interessante Option auch für die Länder sein, die bisher keinen Impfstoff produzieren.