Forschungsbericht 2013 - Max-Planck-Institut für molekulare Biomedizin
Wie Unterschiede im Blutfluss die Vernetzung der Blutgefäße beeinflussen
Einleitung
Das Blutgefäßsystem besteht aus Arterien, die das Blut vom Herzen in den Körper transportieren, und aus Venen, in denen das Blut zurück zum Herzen fließt [1]. Die optimale Vernetzung von Arterien und Venen ist wichtig für die Gewebeversorgung mit Sauerstoff und Nährstoffen und für den Abtransport von Stoffwechselendprodukten. Darüber hinaus werden Zellen des Immunsystems und wichtige hormonelle Botenstoffe über das Gefäßsystem in alle Bereiche des Körpers transportiert. Um diese Transportprozesse effizient zu gestalten, hat der Körper verschiedene Mechanismen entwickelt, die zu einer optimalen Vernetzung des Gefäßsystems beitragen. Zum einen muss bei der Neubildung von Blutgefäßen sichergestellt werden, dass sich Arterien und Venen korrekt miteinander verbinden. Des Weiteren müssen während der Embryonalentwicklung nicht mehr benötigte Blutgefäße entfernt werden. Bis jetzt war wenig darüber bekannt, welche Signalwege diese Prozesse steuern und wie sich die Zellen der Blutgefäße miteinander verbinden oder wieder voneinander trennen können. Neue bildgebende Verfahren im Zebrafischembryo konnten nun erstmals Licht auf diese Prozesse werfen. Ein großer Vorteil von Zebrafischembryonen ist ihre Durchsichtigkeit, die es erlaubt, in den Embryo hinein zu schauen. Des Weiteren kann man die Zellen der Blutgefäße in Zebrafischembryonen mittels fluoreszierender Proteine markieren. Benutzt man nun ein Mikroskop, das gezielt diese Proteine zum Leuchten anregt, werden ausschließlich die Blutgefäße sichtbar. Somit kann man das sonst bei der Beobachtung störende umliegende Gewebe ausblenden. Moderne Mikroskope erlauben es darüber hinaus, Zeitrafferaufnahmen durchzuführen. Dazu beobachtet man denselben Embryo über mehrere Stunden und fertigt z. B. alle 15 Minuten eine Aufnahme an. Am Computer können diese Aufnahmen dann zu einem Film von wenigen Sekunden Länge zusammengesetzt werden. Hierdurch lassen sich besonders gut die dynamischen Prozesse der Blutgefäßentwicklung analysieren.
Blutfluss beeinflusst das Gefäßwachstum
Als erstes wollten Arndt Siekmann und sein Team verstehen, wie es neu auswachsenden Blutgefäßen gelingt, sich korrekt miteinander zu verbinden. Um diese Frage zu beantworten, studierten sie, wie sich neue Blutgefäße im Gehirn von Zebrafischembryonen bilden [2]. Hierzu fertigten die Forscher die oben beschriebenen Zeitrafferaufnahmen der sich entwickelnden Gehirnblutgefäße an. Mit diesen Studien konnten sie zeigen, dass sich die ersten Gehirnarterien aus bereits bestehenden Venen bilden (Abb. 1). Die Zellen der sich neubildenden Arterien wuchsen in das Gehirngewebe ein und verbanden sich schließlich mit einer anderen, bereits vorhandenen Arterie. Dies führte zu einer drastischen Veränderung in der Morphologie der arteriellen Zellen, die mit dem Einsetzen von Blutfluss in den Arterien einherging. Die Blutgefäßzellen bildeten nun eine Röhre mit einem Lumen, durch das Blut fließen konnte, und stoppten ihre Wanderungsbewegungen. In Embryonen, in denen der Herzschlag künstlich gestoppt wurde und die deswegen über keinen Blutfluss verfügten, unterblieb die Lumenbildung. Diese Ergebnisse deuten darauf hin, dass Blutfluss eine wichtige Rolle bei der Ausbildung funktionaler Blutgefäße spielt.
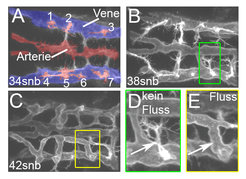
Der Chemokinrezeptor cxcr4a ist wichtig für die korrekte Verbindung zwischen Venen und Arterien
Weiterführende Studien identifizierten einen Rezeptor, der für die Verknüpfung der Gehirnarterien von immenser Wichtigkeit ist. Dieser Rezeptor, cxcr4a, gehört zur Klasse der sogenannten 7-Transmembranrezeptoren, die für die Wanderung verschiedener Zelltypen eine Rolle spielen [3]. In Zebrafischen, in denen die Forscher die Funktion von cxcr4a mittels einer Mutation ausgeschaltet hatten, wuchsen die Arterien anfänglich korrekt aus, konnten sich dann aber nicht richtig mit bereits vorhandenen Arterien verbinden. Dies führte zur Bildung von einem nicht funktionellen Venennetzwerk, das keine Verbindung zum arteriellen Blutstrom aufbauen konnte. Folglich floss kein Blut durch diese Venen, was zu einer Unterversorgung des Gehirngewebes führte.
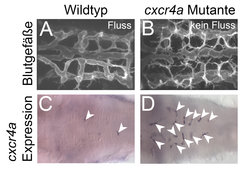
Änderungen im Blutfluss regulieren die Expression von cxcr4a
Interessanterweise konnten die Max-Planck-Forscher zeigen, dass die Expression von cxcr4a stark vom Blutfluss abhängig war. So wurde die cxcr4a-Expression nach dem Auswachsen in korrekt verknüpften und mit Blutfluss versorgten Gefäßen schnell abgeschaltet, während die nicht-funktionellen Gehirnarterien in cxcr4a-Mutanten eine kontinuierlich hohe cxcr4a-Expression zeigten (Abb. 2). Diese Ergebnisse deuten darauf hin, dass cxcr4a eine wichtige Funktion bei der Verknüpfung von neuen Blutgefäßen spielt und so lange in Blutgefäßen angeschaltet bleibt, bis diese eine funktionelle Verbindung eingegangen sind. Im Moment arbeiten die Forscher daran zu verstehen, wie der Blutfluss die Expression von cxcr4a steuert und welche Auswirkungen es auf das Blutgefäßsystem hat, wenn diese Regulation gestört ist.
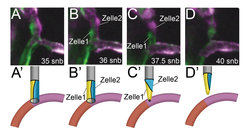
Unterschiede im Blutfluss steuern die Rückbildung von Blutgefäßen
Die oben beschriebenen Prozesse sind wichtig für das anfängliche Ausbilden von Blutgefäßen. Interessanterweise sind diese Blutgefäße noch nicht stabil, sondern können sich wieder zurückbilden. Dieser Prozess, der auch als pruning des Blutgefäßsystems bezeichnet wird, spielt eine wichtige Rolle, um die Transporteffizienz des Netzwerks zu verbessern. So entwickeln sich aus einem primitiven Netzwerk schließlich hierarchisch geordnete Verbindungen von Arterien und Venen [4]. Es war lange Zeit unklar, wie bereits funktionierende Blutgefäße es bewerkstelligen, sich geordnet zurückzubilden, ohne z. B. Blutungen hervorzurufen. Erneut lieferten moderne bildgebende Verfahren in Zebrafischembryonen Einblicke in die Prozesse [5]. Um die Blutgefäßrückbildung zu studieren, markierten die Forscher einzelne Zellen in sich zurückbildenden Blutgefäßen in unterschiedlichen Farben und verfolgten deren Wanderungsbewegungen (Abb. 3). Diese Untersuchungen zeigten, dass sich die Architektur der Gefäße bei deren Zurückbildung änderte. Hatten die Blutgefäße anfangs ein Lumen, das von mehreren Zellen gebildet wurde, bildete sich dieses während des pruning-Prozesses in ein Lumen um, welches nur noch innerhalb einer einzelnen Zelle bestand. Diese Einzelzelle schnürte sich schließlich vom Nachbarblutgefäß ab und unterbrach dadurch den Blutfluss. Dies führte zu einer Rückbildung des Blutgefäßes. Diese Prozesse waren erneut stark vom Blutfluss abhängig. Ohne Blutfluss fand kein pruning statt und das Blutgefäßsystem verweilte in seinem ursprünglichen Zustand. Zusammenfassend deuten diese Ergebnisse darauf hin, dass Blutfluss die Architektur von Blutgefäßen entscheidend beeinflussen kann und dadurch auch zu deren kontrollierter Rückbildung beitragen kann.
Mögliche therapeutische Bedeutung der Ergebnisse
Das bessere Verständnis der Blutgefäße ist wichtig für die Medizin. Denn viele Krankheiten besitzen eine vaskuläre Komponente, das heißt das Blutgefäßsystem spielt für den Krankheitsverlauf eine Rolle. So wird z. B. bei Tumorerkrankungen das Wachstum von Tumoren, aber auch die Metastasenbildung entscheidend von der Blutversorgung des Tumors beeinflusst [6]. Hier könnten die neuen Ergebnisse dazu beitragen, die Tumorblutversorgung so zu verändern, dass es zu geringerem Wachstum des primären Tumors und zu reduzierter Metastasenbildung kommt. Des Weiteren spielen Blutgefäße bei regenerativen Prozessen im Körper eine wichtige Rolle. So könnte eine bessere Blutversorgung von Wunden zu einer beschleunigten Wundheilung führen.


