Forschungsbericht 2006 - Max-Planck-Institut für Biochemie
Chromosomensegregation in Vertebraten
Chromosomensegregation und Mitose (Stemmann, Abteilung Molekulare Zellbiologie, DFG/Emmy Noether) (Dr. Olaf Stemmann)
MPI für Biochemie, Martinsried
Mitose und Meiose im Überblick
Der eukaryontische Zellzyklus wird mit der Entstehung zweier identischer Tochterzellen im Verlauf der aus Mitose und Zytokinese bestehenden M-Phase abgeschlossen. Die exakte Halbierung der genetischen Information in der Mitose beginnt in der Prophase mit der Kondensation der Chromosomen in ihre Transportform, der Auflösung der Zellkernhülle und der Interaktion der chromosomalen Kinetochore mit den Mikrotubuli des sich bildenden Spindelapparates. Erst wenn in der Metaphase alle Chromosomen zur Äquatorialebene der Spindel gewandert sind und eine ordnungsgemäße bipolare Aufhängung erzielt haben, erfolgt in der Anaphase ihre schnelle Trennung in Schwesterchromatiden, welche dann zu den entgegengesetzten Polen der Spindel transportiert werden. Dekondensation der Chromosomen, Reformation der Kernhülle und Disassemblierung der Spindel in der Telophase schließen die Kernteilung ab. Auf sie folgt die Teilung des Zytoplasmas (Zytokinese). Schon seit ihrer ersten detaillierten Beschreibung durch Walther Flemming um 1890 haben die dramatischen, lichtmikroskopisch sichtbaren Vorgänge der Mitose Zellbiologen stets fasziniert. Trotz eines enormen Erkenntniszuwachses in den letzten zehn Jahren sind aber immer noch viele Aspekte der Chromosomensegregation auf molekularer Ebene noch unzureichend verstanden.
Die Regel, dass jeder Kernteilung eine Replikation der Chromosomen in der S-Phase vorhergeht, findet in der Meiose eine Ausnahme: Hier werden zunächst die homologen Chromosomen und dann die Schwesterchromatiden ohne eine zwischengeschaltete Replikation voneinander getrennt. Die Aufrechterhaltung eines stabilen Komplements an Chromosomen erfordert hohe Segregationsgenauigkeit. Fehlverteilungen von Chromosomen in der Mitose sind ein Charakteristikum der meisten Krebsarten und tragen maßgeblich zur Tumorprogression bei. Treten sie in der Meiose auf, resultieren daraus Sterilität oder Trisomien wie das Down-Syndrom, welches die häufigste Ursache für erbliche geistige Behinderung beim Menschen darstellt. Ein genaues Verständnis von Mitose und Meiose sind daher auch von großem klinischen Interesse.
Kohäsion und deren Auflösung
Die „Erfindung“ der Schwesterchromatid-Kohäsion erlaubt es Eukaryonten, die Trennung der Schwesterchromatiden zeitlich von deren Entstehung während der S-Phase zu entkoppeln. Die Paarung wird co-replikativ etabliert, indem ein Multiproteinkomplex, das Kohäsin, beide DNA-Doppelstränge ringförmig umschließt (Abb. 1). Kohäsin besteht aus mindestens vier Proteinen, von denen Smc1 und –3 antiparallele, superspiralisierte Helices bilden, die über eine flexible Region miteinander interagieren. Durch Wechselwirkung ihrer ATPase-Kopfdomänen mit den als Scc1 und –3 bezeichneten Untereinheiten kommt es zum Ringschluss.
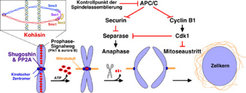
In Vertebraten wird der Zusammenhalt der Schwesterchromatiden in zwei Stufen wieder gelöst (Abb. 1). Früh in der Mitose führt der Prophase-Signalweg zur Öffnung der Kohäsinringe an den Chromosomenarmen. Diese Signalkette hängt von der Aktivität der Proteinkinasen Polo (Plk1) und Aurora B sowie von der Phosphorylierung der Kohäsin-Untereinheit Scc3 ab. Nur an den Zentromeren, also der DNA, die im Bereich der Kinetochore liegt, beschützt ein Komplex aus Protein-Phosphatase 2A (PP2A) und Shugoshin (japanisch für „Beschützergeist“) das Kohäsin vor dieser ersten Dissoziationswelle, vermutlich, indem Scc3 durch PP2A-Shugoshin dephosphoryliert gehalten wird. Am Ende der Metaphase wird auch diese kleine Population an Kohäsin entfernt, indem ihre Scc1-Untereinheit durch Separase geschnitten wird. Die Auflösung dieses letzten Zusammenhalts der Schwesterchromatiden markiert den Beginn der Anaphase. Die stufenweise Aufhebung der Chromosomenpaarung in der Mitose erinnert an die Situation in der Meiose (Abb. 2B). Dort führt die Dissoziation von Kohäsin von Arm- und Zentromerbereichen der Chromosomen zur Trennung der homologen Chromosomen in der Meiose I bzw. der Schwesterchromatiden in der Meiose II. Wieder schützt PP2A-Shugoshin zentromerisches Kohäsin, allerdings diesmal vor einer Separase-abhängigen Spaltung von Rec8 während der ersten Anaphase. Diese meiotische Entsprechung von Scc1 fungiert vermutlich nur nach vorhergehender Phosphorylierung als Separasesubstrat und kann daher durch Dephosphorylierung geschützt werden. Wie PP2A-Shugoshin nach Meiose I inaktiviert wird, um Separase die Spaltung restlichen Kohäsins in der zweiten Anaphase zu ermöglichen, ist noch unklar.
Separase und ihre Regulation
In allen bislang untersuchten Eukaryonten löst Separase in ihrer Funktion als Protease für Kohäsin die letztendliche Trennung der Chromosomen aus. Während ihr erstaunlich sequenzdivergenter N-Terminus vermutlich eine superhelikale Struktur (aus sog. ARM oder HEAT-Wiederholungen) aufweist, ist der C-Terminus Sitz der konservierten Cystein-Endopeptidase-Domäne [1]. Separase liegt normalerweise in einem inaktiven Komplex mit Securin vor, einem Anaphase-Inhibitor, der am Ende der Metaphase über den Ubiquitin-Proteasom-Weg abgebaut wird. Der spezifitätsvermittelnde Ubiquitin-Ligase (E3) Komplex in diesem Prozess ist der APC/C (anaphase-promoting complex or cyclosome). Eine humane Krebszelllinie und sogar Securin knock-out Mäuse zeigen bei Abwesenheit von Securin keinen frühzeitigem Verlust der Schwesterchromatid-Kohäsion [2, 3].
In Übereinstimmung mit dieser Beobachtung konnte am Max-Planck-Institut für Biochemie die Existenz eines weiteren Regulationsmechanismus von Separase nachgewiesen werden. In Extrakten aus Oozyten des Krallenfrosches (Xenopus laevis) lassen sich viele zellbiologische Vorgänge wie Kerntransport, Replikation, programmierter Zelltod (Apoptose) und Zytoskelettbildung rekonstituieren. Beim Studium der Anaphase in diesem Modellsystem zeigte sich, dass ein konstitutiv aktiver Komplex aus Cdk1 (cyclin-dependent kinase 1) und regulatorischem Cyclin B1 die Schwesterchromatid-Trennung inhibiert, ohne jedoch den Abbau von Securin negativ zu beeinflussen [4]. Die Aktivierung der wichtigen Serin/Threonin-Proteinkinase Cdk1 ist notwendig und hinreichend, um Zellen in die Mitose zu treiben. Umgekehrt ist ihre Inaktivierung durch APC/C-abhängigen Abbau von Cyclin B1 für das Verlassen der Mitose essenziell. Der inhibitorische Effekt von Cdk1-Cyclin B1 auf die Anaphase konnte auf die Inhibition von Separase zurückgeführt werden, genauer, auf die inhibitorische Phosphorylierung eines einzigen Serin-Restes etwa in der Mitte der 233 kDa Protease (Aminosäure-Position 1126 im humanen Protein). Die Mutation des Serins in nicht-phosphorylierbares Alanin reichte aus, um Kohäsinspaltung und Schwesterchromatid-Trennung bei hoher, normalerweise restriktiver Kinaseaktivität wiederherzustellen. Seitdem haben zahlreiche Gruppen berichtet, dass physiologische Konzentrationen (also keine Überexpression) von konstitutiv aktiver Cdk1 die Anaphase auch in lebenden mitotischen und meiotischen Zellen inhibieren. Des Weiteren wurde gezeigt, dass embryonale Stammzellen der Maus, welche Separase weder durch Securin noch durch Cdk1 inhibieren können, im Gegensatz zu den Einzelmutanten an verfrühter Trennung ihrer Schwesterchromatiden leiden, wenn sie in der Mitose arretiert werden [5]. Schließlich wurde kürzlich berichtet, dass die Überexpression Cdk1-resistenter, nicht aber wildtypischer Separase zu einem vorzeitigen Verlust an Kohäsion führt [6]. Obwohl in der Metaphase normalerweise der Großteil von Separase mit Securin assoziiert vorliegt, belegen diese Studien also, dass die Cdk1-abhängige Inhibition von Separase ein wichtiger Reserve-Mechanismus ist, der dann eintritt, wenn Securin fehlt oder limitierend wird (Abb. 1).
Der Separase-Cdk1-Komplex
Wissenschaftler am Max-Planck-Institut für Biochemie haben kürzlich auch herausgefunden, dass die Phosphorylierung von Separase für deren Securin-unabhängige Inhibition zwar notwenig, aber nicht hinreichend ist [7]. Überraschenderweise stellte sich heraus, dass der Co-Inhibitor, der an phosphorylierte Separase rekrutiert wird, Cdk1 selbst ist. Obwohl Cdk1 und Securin unterschiedliche Bereiche am Separase-Protein erkennen, schließen sie sich in ihrer Bindung gegenseitig aus. Beide repräsentieren daher parallele und nicht kooperative Inhibitonsmechanismen der Anaphase.
Die Bildung des Separase-Cdk1-Komplexes ist mindestens ein Zweistufen-Mechanismus. In einem ersten Schritt wird Separase zunächst durch Cdk1 und möglicherweise weitere mitotische Kinasen an mehreren Stellen phosphoryliert. Während Phosphorylierung von Serin 1126 zu einer die Cdk1-Bindung erst ermöglichenden Konformationsänderung in der Separase führt, schaffen multiple Phosphorylierungen im Bereich von 1340-1400 eine Bindestelle für die Kinase. In einem zweiten Schritt assoziiert die Cdk1 dann stabil über ihre Cyclin B1-Untereinheit, welche Phosphopeptid-Bindeeigenschaften besitzt, mit diesem Separaseabschnitt. Dieses Modell wird durch eine schwache Sequenzhomologie zwischen den Aminosäuren 1340-1400 von Separase und dem Aminoterminus von Hefe (Saccharomyces cerevisiae) Cdc6 gestützt, da letzterer ebenfalls in phosphorylierter Form als Bindestelle für Cyclin B1 fungiert.
Separase-abhängige Cdk1-Inhibition in der Meiose
Interessanterweise teilen Vertebraten-Separase und Hefe-Cdc6 auch die Eigenschaft, ihrerseits die Aktivität von Cdk1 zu inhibieren. So kann zum Beispiel Separase die Cdk1-abhängige Phosphorylierung des Modellsubstrates Histon H1 verhindern sowie einen durch konstitutiv aktive Kinase bewirkten Mitosearrest überwinden (Abb. 2A).
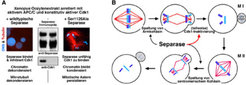
Auf der Suche nach einer biologischen Funktion für diese unerwartete und Proteolyse-unabhängige Eigenschaft von Separase als Inhibitor von Cdk1 wurden Forscher des Max-Planck-Instituts für Biochemie in der Meiose fündig [8]. Es zeigte sich, dass Separase für den Ausstoß des ersten Polkörpers notwendig ist, welcher ein Kennzeichen für den erfolgreichen Abschluss der ersten Reifeteilung weiblicher Keimzellen darstellt [9]. Mikroinjektion eines anti-Separase Peptid-Antikörpers, der zwar die Cdk1-Bindung, nicht aber die Assoziation mit Securin oder die Kohäsinspaltung verhinderte, blockierte den Polkörperausstoß und die zeitgleiche Cdk1-Inaktivierung in Mausoozyten [8]. Der Polkörperausstoß fand jedoch trotz Anwesenheit des inhibitorischen Antikörpers statt, wenn Cdk1 gleichzeitig entweder chemisch oder durch Expression eines Xenopus-Separasefragmentes inhibiert wurde. Die Cdk1-Inaktivierung nach Meiose I muss zwar stattfinden, um die Disassemblierung der Meiose I Spindel zu ermöglichen, sie darf aber nicht vollständig erfolgen, da sonst ungewollte Replikation die Folge wäre. Der Separase fällt bei dieser zellulären Gratwanderung eine Schlüsselstellung zu. Dies ist nicht nur in Vertebraten (Mensch, Maus), sondern auch bei der Bäckerhefe (einem Pilz) der Fall, wenngleich Separase hier auch über einen anderen Mechanismus Cdk1 entgegenzuwirken scheint.
Die jüngsten Ergebnisse verdeutlichen, dass die Regulationsmechanismen in der Anaphase im Allgemeinen und der „riesigen“ Separase im Besonderen noch viele Überraschungen für die Forschung bereit halten.

