Forschungsbericht 2020 - Max-Planck-Institut für molekulare Genetik
Rumpfentwicklung in der Petrischale
Forschung an Säugerembryonen ist schwierig und aufwändig
Die Entwicklung des Embryos aus dem befruchteten Ei ist ein hochkomplexer Vorgang. Bei Säugetieren besteht die Problematik, dass Embryonen im mütterlichen Organismus nicht ungestört beobachtet und untersucht werden können und in der Regel pro Muttertier nur ein oder wenige Embryonen gleichzeitig heranwachsen. Um die Embryonalentwicklung der Maus – einem beliebten Modell für die Erforschung der menschlichen Entwicklung – im Detail zu untersuchen, werden verhältnismäßig viele Tiere benötigt. In den zurückliegenden drei Jahrzehnten sind zwar trotz dieser Einschränkungen viele Fortschritte in der Erforschung embryonaler Prozesse gemacht worden. Dennoch blieb weitgehend unverstanden, wie sich Stammzellen und deren Nachkommen selbst organisieren, um eine komplexe Gestalt mit vielerlei Geweben und Organen hervorzubringen.
Der Rumpf entsteht aus wenigen Stamm- und Vorläuferzellen
In unserer Abteilung Entwicklungsgenetik beschäftigen wir uns mit der Frage, wie bei der Maus der Rumpf gebildet wird, der den größten Teil des Körpers ausmacht. Inzwischen wissen wir, dass wahrscheinlich nur eine Stamm- und wenige Vorläuferzellgruppen beteiligt sind, deren Nachkommen die Anlagen für das Rückenmark, das Skelett und die Skelettmuskulatur, einen Teil des Darmtrakts, Blutgefäße, die Bauchdecke, Nieren und Keimdrüsen sowie verschiedene andere Gewebe formen. Eine wichtige Rolle spielen dabei die sogenannten neuro-mesodermalen Vorläuferzellen. Deren Nachkommen entscheiden sich zwischen dem neuronalen und dem mesodermalen Differenzierungsweg und formen entsprechend entweder das mittig angelegte Neuralrohr, aus dem das Rückenmark mit den Motorneuronen entsteht, oder die beidseitig neben dem Neuralrohr gelegenen Somiten, aus denen das Skelett und die Skelettmuskulatur sowie die Sehnen gebildet werden [1].
Die extrazelluläre Matrix liefert gestaltbildende Signale
Uns ist es nun erstmals gelungen, mithilfe eines neuen 3-D-Verfahrens in einer Zellkultur aus Stammzellen der Maus das Kernstück des embryonalen Rumpfes wachsen zu lassen. Aus embryonalen Stammzellen ließen sich nämlich bislang nur längliche Strukturen züchten, sogenannte Gastruloide, deren Zellen zwar rumpfähnliche Zustände erlangen, aber nicht die typische Gestalt eines Säugetierembryos annehmen. Diesen Strukturen fehlen wichtige Signale, damit sich die Zellen organisieren und sinnvoll anordnen können.
Im Embryo liefert die sogenannte extrazelluläre Matrix wichtige gestaltbildende Signale. Die gallertartige Matrix wird von Zellen ausgeschieden und besteht aus einer komplexen Mischung von langgestreckten Proteinmolekülen, wie sie im Körper vor allem im Bindegewebe vorliegt. In der Zellkultur liefert ein spezielles Gel, das der extrazellulären Matrix ähnelt, die nötigen Signale. Insbesondere verhindert das Gel, dass das Matrixprotein Fibronektin, dessen wichtige Rolle bei der Gestaltbildung schon bekannt war, einfach in die Nährlösung verschwindet. Das Gel gibt den kultivierten Zellen Halt und Orientierung im Raum, sie können nun zum Beispiel zwischen Kontakten mit benachbarten Zellen (innen) und Kontakten mit der Matrix (außen) unterscheiden. Dadurch sind die Zellen in der Lage, sich in Substrukturen zu organisieren und unterschiedliche Organanlagen zu formen. Die Verwendung dieses Gels war der entscheidende Trick des neuen Verfahrens, um rumpfähnliche Strukturen (TLS, für trunk-like structures) zu erzeugen (Abb. 1; [2]).
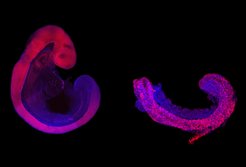
Entstehung und zelluläre Komposition der Strukturen entsprechen dem Embryo
Die Einzelzellanalyse der rumpfähnlichen Strukturen - in Zusammenarbeit mit der Abteilung Genomregulation - zeigte, dass sie genetisch dem Embryo verblüffend ähnlich sind, wenngleich nicht alle Zelltypen des Rumpfes darin vorkommen (Abb. 2). Alle wesentlichen Markergene sind vorhanden und werden zur richtigen Zeit am richtigen Ort aktiviert, nur eine kleine Zahl an Genen weicht davon ab. Während der Rumpfbildung diktiert ein Oszillator die rhythmische Abspaltung der Somiten vom präsomitischen Mesoderm. Die Live-Bildgebung und genetischen Analysen zeigten, dass der Oszillator auch in den TLS aktiv ist, in einem Embryo-ähnlichen Tempo tickt und der gleichen genetischen Kontrolle unterliegt. Die Somitenbildung in der Petrischale funktioniert also wie im Mutterleib.
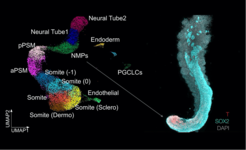
Hinzu kommt, dass die Auswirkungen einer Mutation in den rumpfähnlichen Strukturen schon bekannte Auswirkungen im “echten” Embryo rekapitulieren. Außerdem konnten wir das Entwicklungsgeschehen mithilfe von chemischen Wirkstoffen direkt beeinflussen und insbesondere die Bildung von Somiten zulasten des Neuralrohrs deutlich erhöhen. Dadurch konnten wir bestätigten, dass das Neuralgewebe und die Somiten aus den gleichen Vorläuferzellen hervorgehen, wobei deren Nachkommen miteinander konkurrierende Wege der Differenzierung einschlagen.
Embryo-ähnliche Strukturen verstärken ein neues Forschungsfeld: Synthetische Embryologie
Die rumpfähnlichen Strukturen können aufgrund ihrer Ähnlichkeit nun als Ersatz für den Mausembryo verwendet werden, um die Grundprinzipien der Selbstorganisation bei der Gestalt- und Organbildung im Rumpf eingehend auf Einzelzell- und molekularer Ebene zu untersuchen. Die parallele Herstellung vieler TLS und deren Beobachtung mittels Live-Bildgebung während der Normalentwicklung sowie nach genetischer Perturbation oder Anwendung chemischer Agenzien oder Inhibitoren bietet eine einzigartige Möglichkeit, zu entschlüsseln, welche Mechanismen dafür sorgen, dass die Embryonalentwicklung robust und zuverlässig abläuft.
Das TLS-Modell verspricht eine nie dagewesene Beschleunigung des Erkenntnisgewinns in der Entwicklungsbiologie von Säugern. Da unser System allgemein zugänglich ist und keine Tierhaltung oder lebende Mäuse mehr benötigt, wird die Erforschung der Säugerentwicklung nun viel mehr Laboren offenstehen. Weitere Verbesserungen, die noch Embryo-ähnlichere Strukturen ermöglichen, sind zu erwarten.

