Forschungsbericht 2020 - Max-Planck-Institut für Biochemie
Vermehrungsfähiges Erbgut aus dem Reagenzglas
Ganz von vorn: Bottom-up Ansätze
Um die Grundprozesse des Lebens besser zu verstehen, beschäftigen sich Forscher aus dem Bereich der synthetischen Biologie mit sogenannten bottom-up-Prozessen, also der Erzeugung von lebensähnlichen Systemen aus unbelebten molekularen Bausteinen. Eine der grundlegendsten Eigenschaften aller Lebensformen ist ihre Fähigkeit, sich als abgegrenzte Einheiten selbst zu erhalten und zu reproduzieren. Die künstliche Erzeugung eines Systems, das sich selbst vervielfältigen kann, ist allerdings eine große experimentelle Herausforderung. Es ist uns nun zum ersten Mal gelungen, diese Hürde teilweise zu überwinden und eine derartige Einheit synthetisch herzustellen.
Eine biologische Maschine produziert ihre eigenen Bauteile
Zusammen mit meinem Team widme ich mich der bottom-up Nachstellung der Genomvervielfältigung und Proteinsynthese. Beide Prozesse sind für die Selbsterhaltung und Reproduktion biologischer Systeme elementar. Uns ist es nun kürzlich gelungen, eine Versuchsanordnung im Reagenzglas herzustellen, bei der beide Prozesse gleichzeitig ablaufen, und darüber hinaus zeigte sich, dass unser System dazu in der Lage ist, einen wesentlichen Anteil seiner molekularen Bestandteile selbst zu erzeugen.
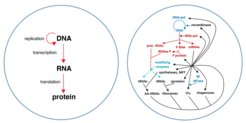
Um diesen Prozess zu starten, benötigten wir vorab eine Bauanleitung sowie verschiedene „molekulare Maschinen“ und Nährstoffe. Übersetzt in biologische Termini handelt es sich bei der Bauanleitung um DNA, die die Information für den Aufbau von Proteinen gespeichert hat. Proteine sind von großer Bedeutung für die zelluläre Biosynthese, unter anderem, weil viele von ihnen zentrale biochemische Reaktionen katalytisch beschleunigen. Um Proteine anhand des DNA-Bauplans herzustellen sind jedoch viele Proteine und RNA-Moleküle notwendig, die über ein Boten-RNA-Zwischenprodukt (Transkription) den genetischen Code in Aminosäureketten übersetzen (Translation; Abb. 1).
Modularer Aufbau der Bauanleitung
Konkret haben wir ein in vitro-Expressionssystem optimiert, das Proteine, ausgehend von einer DNA-Bauanleitung, synthetisiert. Durch verschiedene Verbesserungen ist das System inzwischen in der Lage, sehr effizient DNA-Polymerasen zu synthetisieren. Die DNA-Polymerasen vervielfältigen nachfolgend und unter Verwendung von Nukleotiden die im System vorliegende DNA.
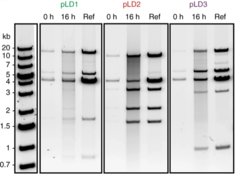
Anders als in früheren Studien kann unser System vergleichsweise lange DNA-Genome ablesen und kopieren. Die künstlichen Genome haben wir dabei aus bis zu 11 ringförmigen DNA-Fragmenten zusammengesetzt. Dieser modulare Aufbau ermöglicht es relativ einfach, bestimmte DNA-Abschnitte in die Bauanleitung einzufügen oder wieder zu entfernen. Das größte in der Studie vervielfältigte modulare Genom besteht aus mehr als 116.000 Basenpaaren und erreicht damit die Genomlänge von natürlichen, sehr einfach aufgebauten Zellen (Abb. 2).
Regeneration der Proteine
Neben den für die DNA-Vervielfältigung wichtigen Polymerasen kodiert unser künstliches Genom weitere Proteine, wie beispielsweise 30 verschiedene Translationsfaktoren, die ursprünglich aus dem Bakterium Escherichia coli stammen. Translationsfaktoren sind wichtig für die Übersetzung der DNA-Bauanleitungen in die jeweiligen Proteine und daher essentiell für selbstvervielfältigende Systeme. Um zu zeigen, dass das neue in-vitro-Expressionssystem nicht nur DNA nachbilden, sondern auch seine eigenen Translationsfaktoren herstellen kann, haben wir die Menge der vom System produzierten Proteine mit Hilfe der Massenspektrometrie ermittelt. Überraschenderweise zeigte sich, dass ein Teil der Translationsfaktoren nach der Reaktion sogar in größeren Mengen vorhanden waren als sie zuvor eingesetzt wurden. Dies werten wir als einen bedeutenden Schritt in Richtung eines sich kontinuierlich selbstvervielfältigenden Systems, das biologische Vorgänge nachahmt.
In Zukunft möchten wir das künstliche Genom um weitere DNA-Abschnitte erweitern und in Zusammenarbeit mit Kolleginnen und Kollegen ein umhülltes System anfertigen, das in der Lage ist, durch Zugabe von Nährstoffen und gleichzeitiger Entsorgung von Abfallprodukten über einen längeren Zeitraum aktiv zu bleiben. Eine solche Minimalzelle könnte dann beispielsweise in der Biotechnologie als maßgeschneiderte Produktionsmaschine für Substanzen aller Art verwendet werden oder als Plattform dienen, um weitere, komplexere lebensähnliche Systeme zu bauen.
Literaturhinweise
Nature Communications 11: 904 (2020)

