Forschungsbericht 2010 - Max-Planck-Institut für Biochemie
Regulation der Genomstabilität durch Ubiquitin und SUMO
Max-Planck-Institut für Biochemie
Das Ubiquitin-System
Jede Zelle verfügt über eine große Anzahl von Proteinen, die maßgeblich die Lebensfunktionen steuern. Dabei übernimmt jedes Protein spezielle Aufgaben, die durch nachträgliche Modifikationen der Proteine aber auch verändert werden können. Bekannte Modifikationen sind zum Beispiel Phosphorylierungen, Acetylierungen, Methylierungen und Glykosylierungen. Eine ungewöhnliche Art der Protein-Modifikation ist das kovalente Anknüpfen des kleinen Proteins Ubiquitin an andere Proteine. Diese so genannte Ubiquitylierung vermittelt verschiedene zelluläre Funktionen. Eine zentrale Rolle der Ubiquitylierung ist das Markieren von Proteinen für deren Abbau durch das Proteasom, eine große, tonnenförmige Protease. Selektiver Abbau von Proteinen durch das Ubiquitin-Proteasom-System (UPS) ist beispielsweise bedeutsam, um defekte Proteine einer Zelle zu entfernen. Neben dieser molekularen „Müllabfuhr“ vermittelt das UPS auch den Abbau von regulatorischen Proteinen, um deren Tätigkeiten zeitlich zu begrenzen.
Ubiquitin wird normalerweise an Lysinreste von zellulären Proteinen angeknüpft und erfordert dafür den Einsatz von verschiedenen Enzymen. Ubiquitin selbst kann ebenfalls ubiquityliert werden, sodass Poly-Ubiquitin-Ketten entstehen. Proteine, die mit diesen Poly-Ubiquitin-Ketten modifiziert sind, werden anschließend von speziellen Escort-Proteinen erkannt, die die Proteine an das Proteasom zum Abbau weiterleiten [1].
Die Ubiquitin-Familie
Neben dem Abbau von Proteinen vermittelt die Ubiquitylierung noch weitere Funktionen, wie das Sortieren oder den Transport von Proteinen innerhalb einer Zelle. Für diese Funktionen werden Proteine jedoch meistens nur mit einem Ubiquitin-Molekül verknüpft (Mono-Ubiquitylierung). Ubiquitin dient hier als Bindestelle für andere Proteine, die beispielsweise den Transport des ubiquitylierten Proteins vermitteln.
Außer Ubiquitin besitzt die Zelle andere Proteine, die mit Ubiquitin verwandt sind. Dazu gehört das Protein SUMO (small ubiquitin-like modifier), das wie Mono-Ubiquitin nicht den Abbau über das Proteasom einleitet [2]. Weitere Proteine der Ubiquitin- Familie wirken regulierend auf das Ubiquitin-System oder steuern den Abbau von größeren Zellbausteinen durch einen Prozess, der Autophagie genannt wird.
DNA-Reparatur
In unserer Forschungsgruppe stehen Modifikationen durch Ubiquitin und verwandten Proteinen im Zentrum der Forschung. Ein wichtiger Aspekt der Arbeiten ist die Rolle von Ubiquitin und SUMO bei der Reparatur der DNA sowie der Toleranz gegenüber DNA-schädigenden Einflüssen [2]. Krankheiten wie Krebs entstehen durch DNA-Schäden, die durch UV-Strahlung entstehen können. Um dies zu verhindern, hat die Zelle verschiedene Möglichkeiten, DNA wieder instand zu setzen oder die Schäden zu vermeiden.
An Hefezellen als Modell werden Reparaturmechanismen erforscht, die bei der Verdoppelung der DNA während der Zellteilung zum Einsatz kommen oder gebrochene Chromosomen wieder heilen können. Dabei wurde erstmals gezeigt, dass Ubiquitin für die DNA-Reparatur elementar ist und dass die Verknüpfung des Proteins PCNA (proliferating cell nuclear antigen) mit Ubiquitin und SUMO eine entscheidende Rolle bei der Vermeidung von DNA-Schäden spielt (Abb. 1; [3-5]). PCNA schließt sich ringförmig als Homotrimer, also bestehend aus 3 identischen Einheiten, um den DNA- Strang und fungiert als Hilfsprotein für DNA-Polymerasen, die das Genom vor der Zellteilung verdoppeln [6, 7].
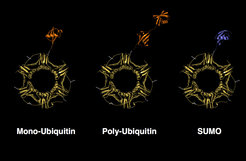
Wenn die DNA jedoch beispielsweise durch UV-Licht geschädigt wurde, kann es bei der Replikation zu Problemen kommen, da eventuell die DNA-Polymerasen am Ort des DNA-Schadens arretieren, also stehen bleiben und die Verdopplung der DNA dort zum Stillstand kommt. Dies kann zu Chromosomenbrüchen führen, was beim Menschen Krebs auslösen kann. Um dies zu vermeiden, aktiviert die Zelle einen Schutzschalter, den wir PCNA switch genannt haben [3-5]. Wir fanden, dass bei Bedarf das Protein PCNA an dem gleichen Lysinrest entweder mono-ubiquityliert, poly-ubiquityliert oder mit SUMO verknüpft ("SUMOyliert") wird. Die Poly-Ubiquitin-Kette hat in diesem Fall eine spezielle Struktur, die nicht zum Abbau des PCNA-Proteins führt [3]; sie erlaubt eine Verdoppelung des Genoms, ohne dass es zu Fehlern kommt. Wenn PCNA mono-ubiquityliert wird, werden spezielle DNA-Polymerasen an PCNA angekoppelt, die auch defekte DNA verdoppeln können. Diese translesion Polymerasen können aber am Ort des DNA-Schadens einen falschen Baustein einsetzen und so eine Mutation kreieren. Mutationen sollten in der Regel vermieden werden - jedoch ohne Mutationen gibt es wiederum keine genetischen Veränderungen. Deshalb ist der hier beschriebene error-prone Weg essenziell für die Entstehung neuer Arten [3, 5]. Die SUMOylierung von PCNA verhindert wiederum einen dritten, nicht ungefährlichen Ausweg, nämlich den der Rekombination, bei der Chromosomenbrüche entstehen können, und erleichtert zudem die zwei Ubiquitin-abhängigen Prozesse [4]. Die hier dargestellten Mechanismen sind auch beim Menschen hochwirksam und tragen zum Schutz der Erbsubstanz maßgeblich bei. Der PCNA switch schützt beim Menschen die Genomstabilität und verhindert die Ausbildung von Tumoren.
Ausblick
Die Entdeckung, dass Ubiquitin auch DNA-Reparatur und Genomstabilität vermittelt, war überraschend und eröffnete ein neues, sehr aktives Forschungsgebiet. Es ist anzunehmen, dass Proteine der Ubiquitin-Familie viele weitere Prozesse der Zelle steuern, sodass in diesem Forschungsfeld weitere Überraschungen zu erwarten sind.
