Forschungsbericht 2011 - Max-Planck-Institut für Infektionsbiologie
Wegweisende Ansätze zur resistenzsicheren Behandlung akuter und chronischer Infektionen
Innovative approaches towards a resistance-proof treatment of acute and chronic infections
Die Wiederkehr der Influenza
Trotz glimpflichen Verlaufs der letzten Influenzapandemie mit dem H1N1 Schweinegrippevirus im Jahr 2010 haben Grippeviren keineswegs an globalem Schreckenspotenzial verloren (Abb. 1). Erst kürzlich wurden auf dem Weg natürlicher Selektion hochansteckende Varianten des Vogelgrippevirus H5N1 experimentell erzeugt, die hohes Ansteckungspotenzial mit einer extrem hohen Mortalität (etwa 60%) vereinen. Abgesehen jedoch von diesen frappierenden Laborversuchen ist Influenza durch seine saisonalen Epidemien bekannt, die sich rasch über den gesamten Erdball ausbreiten. Nach Schätzungen der Weltgesundheitsorganisation (WHO) sind 5-15% der Weltbevölkerung betroffen mit 250000 bis 500000 Todesfällen vor allem in den Risikogruppen Älterer und chronisch Kranker. In Deutschland allein sterben nach Angaben des Robert Koch-Instituts bis zu 15000 Menschen an den Folgen der jährlichen Influenza.
Influenzaviren stehen beispielhaft für zahlreiche Mikroben, die mit ihrer ausgeprägten Variabilität unser Immunsystem täuschen und mit Leichtigkeit Resistenzen gegen Antibiotika und antivirale Medikamente entwickeln. Aufgrund dieser Eigenschaft sind wir zur Entwicklung immer neuer Impfstoffe und Medikamente gezwungen und können gefährlichen Pandemien mit neuen Erregervarianten nur mit Mühe entgegentreten. Dies gilt für die derzeit verfügbaren Behandlungsmethoden, die – wie unser Immunsystem – erregergerichtet sind, das heißt, eine Blockade erregereigener Funktionen verfolgen. Als grundsätzliches Problem dabei stellt sich jedoch die ausgeprägte Mutations- und Rekombinationsfähigkeit der Erreger heraus, mit deren Hilfe sie dem Angriff auf ihre Funktionen rasch ausweichen und Resistenzen entwickeln.
Der "wirtsgerichtete" Behandlungsansatz
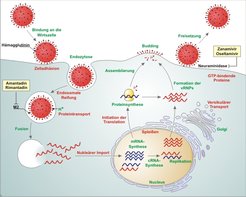
Forscher der Abteilung Molekulare Biologie am Institut arbeiten daher an einer neuen Therapieform, die im Gegensatz zur Behandlung mit herkömmlichen, „erregergerichteten“ Antiinfektiva „wirtsgerichtet“ ist. Der neue Ansatz macht sich die Erkenntnisse infektionsbiologischer Forschung vergangener Jahrzehnte zunutze, wonach das Zustandekommen jeglicher Infektion immer sowohl von Faktoren des Erregers (Virulenzdeterminanten) als auch des Wirtsorganismus abhängt. Nur wenn Faktoren eines Erregers mit denen des Wirts passgenau interagieren, findet eine Infektion tatsächlich statt. Da insbesondere virale Erreger für ihre Vermehrung Hunderte von Faktoren der menschlichen Zelle benötigen (Abb. 2), sollte es möglich sein, durch Blockade solcher Wirtsfaktoren eine Infektion erfolgreich zu unterbinden. Dieser Ansatz birgt zwar, wie übrigens auch die Antibiotika-Einnahme, potenzielle Risiken; bedenkt man allerdings, dass viele Menschen täglich Medikamente, die nichts weiter als bestimmte körpereigene Funktionen blockieren, auch über längere Zeit hinweg mit großem Erfolg einnehmen, erscheint der neue Ansatz machbar und vielversprechend. Ziel der laufenden Forschung ist es daher zunächst, körpereigene Faktoren zu definieren, die zwar für die Erregervermehrung unumgänglich sind, deren vorübergehender Verlust (im Rahmen einer zeitlich begrenzten Therapie) für den Menschen jedoch gut verträglich ist. Theoretischer Vorteil der wirtsgerichteten Therapie: Der Erreger kann im Gegensatz zur herkömmlichen antimikrobiellen Behandlung durch einfache Mutation keine Resistenzen mehr entwickeln.
Screening nach geeigneten Zielstrukturen
Die Suche nach brauchbaren wirtseigenen Zielstrukturen (targets) der Influenzainfektion wurde kürzlich von der Arbeitsgruppe am Institut erfolgreich abgeschlossen. Sie war durch den systematischen Einsatz der RNA-Interferenz (RNAi) möglich, einem wichtigen Prozess der Genregulation in eukaryotischen Zellen, deren Entdecker im Jahre 2003 mit dem Nobelpreis für Medizin ausgezeichnet wurden. Mittels RNAi und dem Einsatz leistungsfähiger Roboter ist es heute prinzipiell möglich, im Reagenzglas jedes einzelne Gen einer menschlichen Zelle abzuschalten [1]. Hierzu werden die Zellen mit kleinen interferierenden RNA-Molekülen (siRNA) behandelt, um die einzelnen betreffenden Genfunktionen hinsichtlich ihrer Rolle bei der Erregervermehrung zu testen. Im Falle von Influenzaviren konnte die Arbeitsgruppe insgesamt 287 menschliche Gene identifizieren, deren Ausprägung einerseits für die Virusvermehrung notwendig, andererseits für die Zellfunktion entbehrlich ist [2]. Die betreffenden Genfunktionen und daraus resultierenden Proteine kommen nun als Zielstrukturen für die Entwicklung der neuartigen resistenzsicheren Medikamentenklasse in Betracht.
Neue Medikamente gegen Grippeviren
Um diesen Ansatz bis zur Medikamentenreife hin weiterzuentwickeln, hat das Institut die Koordination für das ANTIFLU-Vorhaben aus dem 7. Forschungsrahmenprogramm der EU übernommen (http://www.antiflu-project.eu/). Ziel ist es, auf der Grundlage der identifizierten targets im Kreis ausgewiesener europäischer Kooperationspartner, darunter auch des Lead-Discovery-Centers (LDC) der Max-Planck-Gesellschaft, so genannte lead-Verbindungen als Vorläufer für ein breitwirkendes und resistenzsicheres Medikament gegen Influenzainfektionen zu entwickeln. Dafür wird ein Zeitraum von fünf Jahren veranschlagt. Im Anschluss daran sollen sich die klinischen Prüfungen anschließen. Sollte das Vorhaben gelingen, wäre damit am Beispiel von Influenza der Beweis für die Machbarkeit der wirtsgerichteten Therapie bei akuten Infektionsverläufen erbracht.
Hilfe gegen chronische Chlamydieninfektionen
Der eingeschlagene Weg könnte auch bei chronischen Infektionen greifen: Denn Chlamydien tendieren als obligat intrazelluläre bakterielle Erreger dazu, bei erfolgloser Antibiotikabehandlung im menschlichen Organismus zu persistieren und Langzeitschäden zu verursachen. Chlamydia trachomatis mit seinen knapp 90 Millionen Neuinfektionen pro Jahr ist beispielsweise die Hauptursache von Sterilität bei Frauen und ektopischen Schwangerschaften. Die MPI-Forscher arbeiten daher an einer genomweiten Analyse von Wirtszellfaktoren, die bei Chlamydieninfektionen eine Rolle spielen. Ein erster Zwischenstand wurde mit der Identifizierung essenzieller Proteinkinasen bereits erreicht [3]. Mit einer gezielten wirtsgerichteten Behandlung, gegebenenfalls in Kombination mit Antibiotika, könnten zukünftig nachhaltigere Therapieerfolge erzielt werden. Auch in Kombination mit Impfstoffen könnte die wirtsgerichtete Therapie von Vorteil sein.
Verbesserung der Impfstoffproduktion
Interessanterweise haben die Analysen menschlicher Genfunktionen noch ein weiteres Ergebnis erbracht: So wurden zahlreiche Gene identifiziert, deren Abschaltung die Erregervermehrung nicht beeinträchtigt, sondern vielmehr begünstigt. Es handelt sich offenbar um antimikrobielle Determinanten, die normalerweise die Erregervermehrung bremsen. Im Zusammenhang mit Influenza könnte dieser zunächst als unbrauchbar erscheinende Befund einen Vorteil bei der Impfstoffgewinnung gegen Influenzainfektionen bergen: Die Herstellung eines neuen Impfstoffs erfordert nämlich die Anzucht von Viren im großen Stil und benötigt mehrere Monate, ausgehend von einem „Saatvirus“. Im Pandemiefall wäre diese Zeitspanne für eine erfolgreiche Vakzinierungskampagne vermutlich zu groß. Sollte es gelingen, durch das Abschalten antiviraler Genfunktionen verbesserte Zelllinien zu generieren, die ein Vielfaches an Virusproduktion gewährleisten, so wären die Rahmenbedingungen für eine schnelle und erfolgreiche Impfstoffgewinnung wesentlich verbessert. Ein vom Bundesministerium für Bildung und Forschung unterstütztes Vorhaben, das gemeinsam mit dem Max-Planck-Institut für Dynamik komplexer technischer Systeme in Magdeburg durchgeführt wird, soll diese Entwicklungslinie zukünftig unterstützen.
Individuelle Prädisposition für Infektionen
Die beispielhaft mit Influenzaviren und Chlamydien durchgeführten globalen Genfunktionsanalysen beinhalten aber noch einen weiteren erheblichen Erkenntnisgewinn. Menschen reagieren bekanntlich oft unterschiedlich gegenüber Infektionserregern. Dies betrifft die Empfänglichkeit gegenüber Infektionserregern wie auch den Schweregrad und den Verlauf von Infektionen. Die Ursachen hierfür liegen, neben ernährungsbedingten Einflüssen, in unserer individuellen genetischen Ausstattung. Viele unserer Gene sind polymorph, kommen also in unterschiedlichen genetischen Ausprägungen vor, die auch Unterschiede in der Funktionalität der Genprodukte bewirken. Da nun mit den oben skizzierten genomweiten Analysen all diejenigen menschlichen Gene identifiziert wurden, die wichtige Funktionen bei einer Infektion innehaben, ist anzunehmen, dass Polymorphismen in genau diesen Genen den Infektionsverlauf positiv oder negativ beeinflussen. Infektionsepidemiologische Analysen auf der Grundlage der identifizierten Wirtsdeterminanten könnten daher wichtige Aussagen zur individuellen Prädisposition gegenüber Infektionskrankheiten ermöglichen.
Ausblick
Wie sich zeigt, haben die am Institut initiierten globalen Funktionsanalysen des menschlichen Genoms bezüglich akuter (Influenzaviren) wie auch chronischer (Chlamydien) Infektionskrankheiten neue Wege zu einem besseren Verständnis der Rolle des Wirtsorganismus im Infektionsprozess eröffnet und darüber hinaus Weichen für eine bisher ungenutzte Therapieform gestellt, nämlich der wirtsgerichteten Infektionsbehandlung. Diese Therapieform verspricht eine hohe Resistenzsicherheit und wird für sich, oder auch in Kombination mit Antibiotika oder Impfstoffen, unser Repertoire im andauernden Kampf gegen Krankheitserreger wesentlich erweitern. Darüber hinaus werden sich aus den erhobenen Befunden wichtige Informationen zur individuellen Empfänglichkeit gegenüber Infektionserregern ableiten lassen. Schlüssel zu dieser neuen Erkenntnis war die systematische Anwendung der RNAi-basierten Screeningtechnologie. Ähnliche Untersuchungen mit anderen bedeutsamen Krankheitserregern des Menschen werden folgen.

