Forschungsbericht 2015 - Max-Planck-Institut für Biochemie
Autophagozytose: Das multifunktionale Recyclingsystem der Zelle
Autophagy: the multifunctional recycling system of the cell
Die zelluläre Müllentsorgung
Alle Lebewesen bestehen aus Zellen, die wie bei einzelligen Organismen entweder autonom existieren oder im Verbund mit anderen Zellen spezielle Aufgaben übernehmen. Allen ist gemein, dass ihre Bestandteile, wie beispielsweise Proteine oder Organellen, funktionsunfähig oder beschädigt werden können. Geschieht dies mit den Kraftwerken der Zelle, den sogenannten Mitochondrien, werden toxische Substanzen frei, die das Erbgut schädigen und somit zum Sterben der Zelle oder deren Entartung führen. Um dies zu verhindern, haben Zellen ein hocheffizientes Recyclingsystem entwickelt. Es sammelt beschädigte zelluläre Bestandteile ein und isoliert sie somit. Anschließend werden sie zu den Recyclingstationen der Zelle, den Lysosomen, transportiert und in ihre Bestandteile zerlegt. Ein unzureichendes Recycling kann jedoch zur Akkumulation von zellulärem Abfall und als Konsequenz zur Entstehung von neurodegenerativen Erkrankungen wie beispielsweise Alzheimer oder Krebs beitragen.
Wie schaffen es Zellen, Abfall zu erkennen und zu isolieren? Sie produzieren eine Art Recycling-Container, mit denen sie den Abfall zuerst einsammeln und dann umschließen. Diese Container müssen sich den zellulären Strukturen, die sie einschließen sollen, anpassen können und zudem aber stabil sein. Diesen offensichtlichen Widerspruch löst die Zelle ähnlich wie wir es tun: Sie bildet einen flexiblen Müllsack, bestehend aus Membranen, die nicht nur die Zelle selbst, sondern auch Organellen umgeben und sie somit abschirmen und begrenzen, und einen stabilen Container. Die Membranen können mit Hilfe der Elektronenmikroskopie sichtbar gemacht werden (Abb. 1).
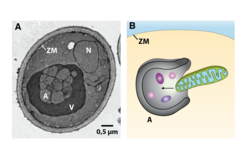
Wie diese Membranen stabilisiert werden, war jedoch unbekannt und Gegenstand der Studien der Forscher. Proteine, die vermutlich an der Stabilisierung der Membran beteiligt sind und somit einen Container bilden können, steuern auch das Wachstum des Autophagosoms und somit seine Größe. Diese Faktoren können benutzt werden, um gezielt in das zelluläre Abfallsystem einzugreifen und auf diese Weise Krankheiten wie Krebs oder Alzheimer zu therapieren. Wenn beispielsweise größere Autophagosomen gebildet würden, könnte mehr Müll eingesammelt werden und Proteinklumpen, wie sie sich in Nervenzellen bei der Alzheimerschen Erkrankung ansammeln, könnten effizienter beseitigt werden. Würde man im Gegensatz dazu verhindern, dass die Zelle Autophagosomen bildet, sammelt sich zellulärer Abfall an. Eine Behandlung von Krebs mittels Chemotherapie, deren Ziel es ist, Krebszellen irreparabel zu schädigen, wäre somit effizienter und besser verträglich. Diese beiden Beispiele zeigen, dass es von großem medizinischen Interesse und Nutzen ist, die Autophagozytose zu steuern.
Die Autophagozytose im Reagenzglas nachgebaut
Um zu verstehen, wie sich Autophagosomen bilden, muss man zunächst die molekularen Maschinen identifizieren, die diesen Prozess vorantreiben und steuern. Dies wurde mit Hilfe genetischer Untersuchungen in Hefezellen erreicht. Sie produzieren, ähnlich menschlicher Zellen, Autophagosomen, und die Proteine, die daran beteiligt sind, haben vieles gemeinsam. Daher können Erkenntnisse über den Ablauf der Autophagozytose in Hefe auf den Prozess in menschlichen Zellen übertragen werden. Im Gegensatz zu menschlichen Zellen sind alle relevanten Proteine, die an der Autophagozytose in Hefezellen beteiligt sind, identifiziert worden. Ihre Funktion war jedoch bislang weitgehend unklar. Dies liegt vor allem daran, dass gängige biochemische und zellbiologische Verfahren zur Charakterisierung der Proteine fehlschlugen.
Ein innovativer Weg, der sich schon bei der Untersuchung anderer Mechanismen der Abfallentsorgung bewährt hat, versucht, den Prozess im Reagenzglas nachzubauen [1]. Dazu werden die Bestandteile, zum einen Proteine und zum anderen Membranen, unter kontrollierten Bedingungen im Reagenzglas zusammengebracht. Die Membranen bilden dabei die Plattform, auf der sich diejenigen Proteine, die bei der Autophagozytose eine Rolle spielen, zu molekularen Maschinen zusammensetzen. Der Aufbau und die Aktivität der molekularen Maschinen kann nachfolgend mit verschiedensten biochemischen und biophysikalischen Methoden untersucht werden.
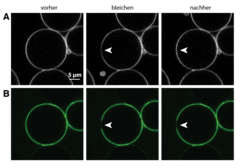
Viele dieser Methoden basieren auf der Beobachtung von Proteinen und Membranen mittels Fluoreszenzmikroskopie. Dazu werden die Proteine rekombinant hergestellt, das heißt, das Gen, das ein entsprechendes Protein kodiert, wird in Bakterienzellen eingeführt. Die Bakterien produzieren das Protein daraufhin in großen Mengen, sodass es anschließend nach Aufschluss der Bakterienzellen gereinigt werden kann. Am Ende wird das Protein mit Fluoreszenzfarbstoffen markiert. Die Membranen wiederum werden aus synthetisch hergestellten Lipiden erzeugt. Eines dieser Lipide ist mit einem fluoreszierenden Farbstoff markiert mit der Folge, dass die Membran ebenfalls fluoresziert. Die Beweglichkeit der Proteine kann auf den Membranen nun dadurch untersucht werden, dass man in einem eng begrenzten Bereich die Fluoreszenz ausschaltet, indem man die Farbstoffe mit hochenergetischem Laserlicht beschießt. Die Vermischung von gebleichten Proteinen mit denen aus der nicht gebleichten Region gibt dann Aufschluss über deren Beweglichkeit. Im Falle des Proteingerüstes zeigte sich, dass keine Durchmischung stattfindet, die Proteine also unbeweglich auf der Membran sind [2]. Das ist die Grundvoraussetzung dafür, dass sie einen stabilisierenden Container aufbauen können (Abb. 2).
Dem Container auf den Zahn gefühlt
Der Container braucht Struktur, und die Erkenntnisse aus den Fluoreszenzexperimenten legen nahe, dass sich die untersuchten Proteine zu einer starren Hülle zusammenlagern, die die Membran des Autophagosoms umgibt und stabilisiert. Um die Struktur der Proteinhülle zu untersuchen, kam ein anderes biophysikalisches Messverfahren zum Einsatz, die sogenannte atomare Kraftmikroskopie. Dabei tastet eine hochempfindliche, nadelartige Spitze die Oberfläche ab. Jede Erhebung wird durch die Spitze registriert. Da die Membran selbst sehr eben und flach ist, werden Erhebungen, die durch die sich auf der Membran befindenden Proteine hervorgerufen werden, registriert und in Form eines Höhenprofils dargestellt. Diese Untersuchungen zeigten, dass sich die Hüllenproteine zu einem flachen Gerüst auf der Membran zusammensetzen. Dieses Gerüst ist nur wenige Nanometer (millionstel Millimeter) hoch, bildet aber auf vergleichbar großen Membranflächen eine homogene Gerüststruktur aus (Abb. 3).

Biochemische und zellbiologische Untersuchungen konnten zudem zeigen, wie das Gerüst aufgebaut ist und wie dessen Komponenten miteinander interagieren [2]. Genau diese Erkenntnisse bilden die Grundlage für die Entwicklung von Medikamenten, die gezielt in den Aufbau des Gerüstes und folglich in die Entstehung von Autophagosomen eingreifen können. Neuartige Therapien zur Behandlung neurodegenerativer Erkrankungen oder Krebs wären die Folge.


