Forschungsbericht 2003 - Max-Planck-Institut für Biochemie
Regulation von Zellteilung und -wachstum
Regulation of cell growth and division
Intrazellulärer Proteintransport (Barr, MPI) (Dr. Francis Barr)
MPI für Biochemie, Martinsried
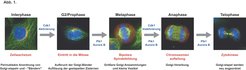
Wachstum und Teilung tierischer Zellen erfordert die ständige Zufuhr neuer Proteine und Lipide von ihrem Herstellungsort im Endoplasmatischen Retikulum an die Zelloberfläche. Dem Zellwachstum und der DNA-Verdopplung in der S-Phase folgt zunächst die geregelte Aufteilung des genetischen Materials in zwei identische Chromosomensätze in der M-Phase und dann die eigentliche Zellteilung (Zytokinese), welche die Zelle so entzweischneidet, dass jeder entstehende Teil einen Satz des genetischen Materials erhält (Abb. 1). Die Untersuchung dieser Prozesse und ihrer Regulation auf molekularer Ebene ist daher wichtig, um zu verstehen, wie sich normale Zellen teilen, und wie - falls die Zellteilung nicht stattfindet - die aneuploiden Zellen, die zur Bildung von Tumoren beitragen, entstehen.
Meine Arbeitsgruppe beschäftigt sich mit der Fragestellung, wie menschliche Zellen die komplexen dreidimensionalen Strukturen, die sie für Zellwachstum und -teilung benötigen, bilden und regulieren. Um diese Frage zu beantworten, haben wir uns auf zwei wichtige Bereiche konzentriert: (i) Proteintransport und die Funktion des Hauptorganells des sekretorischen Weges, des Golgi-Apparates und (ii) die Funktion der zentralen Spindelregion für die Proteintransportereignisse, die letztendlich zur Zytokinese führen.
i.i Proteintransport und die Funktion des Golgi-Apparates
In den meisten Tier- und Pflanzenzellen findet man den Golgi-Apparat als einen Stapel von zisternenförmigen Membranen. Diese Membranstapel können dann entweder in bandähnlichen Strukturen angeordnet sein oder wie in Pflanzenzellen als unabhängige Stapel fungieren. Pilze, wie zum Beispiel Hefe, haben oft Golgi-Stapel, die einen weniger komplexen Aufbau aufzeigen, stattdessen sind die Golgi-Zisternen dort hochmobile Strukturen, die man sowohl in Stapeln als auch einzeln anfinden kann.
Obwohl Golgi-Stapel solch einen komplizierten Aufbau haben, handelt es sich um extrem dynamische Strukturen, durch welche große Mengen an sekretorischem Material und Membran auf ihrem Weg zu ihren verschiedenen Zielen innerhalb der Zelle geschleust werden. Unsere Arbeit konzentriert sich auf die Funktion von Rab GTP-bindenden Proteinen, einer großen Familie an coiled-coil Proteinen, den Golgins und ihren Membranadaptoren, den GRASPs, in verschiedenen Aspekten des Golgi-Aufbaus und der Golgi-Dynamik in tierischen Zellen. An der Oberfläche von Golgi-Zisternen bilden diese Proteine zusammen eine hochdynamische Matrix, die sowohl die Form als auch die Funktion der Zisternen reguliert. Ursprünglich hatten wir die GRASPs, GRASP65 und GRASP55 als Faktoren identifiziert, die erforderlich sind, um die Golgi-Membranen nach der Mitose wieder in einem geordneten Zisternenstapel anzusammeln. Wir konnten weiterhin zeigen, dass die GRASPs notwendig sind, um eine Untergruppe von Golgins an den Golgi-Apparat zu lokalisieren. GRASP65 und sein Golgin-Interaktionspartner GM130 befinden sich am frühen oder cis-Teil des Golgi-Apparates, während GRASP55 und sein Partner Golgin-45 an den medialen Golgi-Zisternen lokalisiert sind. Kürzlich konnten wir zeigen, dass sowohl GM130 als auch Golgin-45 eine Untergruppe von Golgi-assoziierten Rab-Proteinen binden. Dies scheint eine generelle Eigenschaft der Golgins zu sein, da wir festgestellt haben, dass fast alle bekannten Golgins ebenfalls mit Golgi-assoziierten Rab-Proteinen interagieren. Wir glauben, dass die GRASP-Golgin-Komplexe als Markenzeichen fungieren und den unterschiedlichen Zisternen innerhalb des Golgi-Stapels ihre Identität geben, die sowohl für die räumliche Organisation als auch für die Vesikelerkennungsschritte während des Membranstransportes notwendig ist.
Doch nicht alle Golgins regulieren Interaktionen zwischen Golgi-Membranen und Vesikeln; manche Golgins können auch Wechselwirkungen zwischen Membranen und dem Zytoskelett beeinflussen. Bicaudal-D1 und -D2 sind zwei Doppelwendel ("coiled-coil")-Proteine der Golgin-Familie, die auf Transport-Vesikeln sitzen. Rab6 reguliert die Bindung der Bicaudal-D-Proteine an Membranen, und dies führt dann zur Rekrutierung des Dynein-Dynactin-Komplexes, der wichtig ist für Mikrotubuli-abhängige Vesikelbewegung.
Unsere momentane Arbeit zielt darauf hin zu verstehen, wie Rab-Proteine das komplizierte Netzwerk von Interaktionen zwischen den unterschiedlichen Golgins regulieren, und welche Rolle dies in der Kontrolle des Membranentransportes spielt.
i.ii. Neue Funktionen für Golgi-assoziierte Signaltransduktionswege
Seit kurzem gibt es Hinweise darauf, dass der Golgi-Apparat neben seiner Rolle in der Proteinsekretion auch bei verschiedenen zellulären Signalisierungsvorgängen von Bedeutung ist. So wurde zum Beispiel vorgeschlagen, dass der Golgi-Apparat als eine Art Signalisierungplattform agieren könnte, über welche externe Wachstumsfaktorsignale sowohl wahrgenommen als auch integriert werden könnten und die weiter folgende Ereignisse somit maßgeblich beeinflussen könnte. Wir haben uns darauf konzentriert zu untersuchen, welche zellulären Prozesse sowohl die Koordination von Signalisierungsereignissen an der Zelloberfläche als auch die unterschiedlichen Funktionen des Golgi-Apparates benötigen. Daraufhin haben wir vor kurzem zwei Mitglieder der MST-Familie der STE20-Kinasen, YSK1 und MST4, als Golgi-assoziierte Kinasen identifiziert (Abb. 2A). Diese beiden Kinasen interagieren mit dem Golgi-matrix-Protein GM130 und werden von diesem sowohl an den Golgi-Apparat gebunden als auch in ihrer enzymatischen Tätigkeit aktiviert, wo hingegen das dritte und sehr nahe verwandte Familienmitglied MST3 nicht am Golgi-Apparat zu finden ist und auch GM130 nicht bindet. Eine nähere Charakterisierung der Funktion von YSK1 zeigte, dass eine dominant-negative Form von dieser Kinase in der Lage ist, sowohl die Zellmigration als auch die Einwanderung in Kollagen zu blockieren.
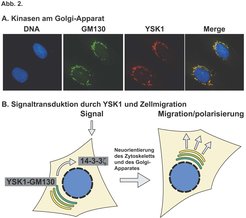
Gerichtete Zellmotilität ist ein hochkomplizierter Prozess, der sich aus vielen unterschiedlichen Ereignissen wie Polarisierung des Zytoskelettes, Signaltransduktion und Regulierung der Zelladhäsionskomplexe zusammensetzt. Veränderungen in der Zellpolarität werden insbesondere von der Neuorientierung des Zytoskelettes und der Sekretion von Proteinen und Lipiden an bestimmte Unterregionen der Plasmamembran begleitet, und Golgi-lokalisierte Kinasen wie YSK1 und MST4 befinden sich in einer idealen Position, um diese Prozesse durch Modulierung der Golgi-Funktion zu beeinflussen. Diese Idee wird durch unsere Daten unterstützt, die 14-3-3ζ als Golgi-lokalisiertes Substrat für YSK1 identifiziert haben, und uns dadurch einen Hinweis geben, wie YSK1 sowohl Golgi-Funktion als auch Zellmigration regulieren könnte (Abb. 2B). 14-3-3-Proteine liegen als Dimere vor und binden typischerweise an phosphorylierte Akzeptorstellen an ihren Zielproteinen. Dadurch regulieren sie eine Vielzahl von zellulären Prozessen. Im Zusammenhang mit unserer Arbeit sind besonders drei Funktionen dieser Proteine von Bedeutung. Erstens ist beschrieben worden, dass 14-3-3ζ an phosphoryliertes Raf in der Ras-Signaltransduktionskaskade binden kann und dessen Aktivität stimuliert. Da infolge von Wachstumsfaktor-Rezeptoraktivierung ein Teil der aktivierten Ras-Proteine am Golgi-Apparat erzeugt wird, ist es möglich, dass YSK1 diesen Teil der Signaltransduktionskaskade über 14-3-3ζ beeinflusst. Zweitens sind 14-3-3-Proteine sowohl in Verbindung mit den zytoplasmatischen Domänen spezifischer Integrinkomplexe gefunden worden, als auch mit Par3/Baz, eins von mehreren Proteinen mit einer wichtigen Rolle in der Kontrolle der Zellpolarität und Zellassymmetrie während der Entwicklung. Überexpression von 14-3-3-Proteinen blockiert die Zellmigration, wahrscheinlich über die Interaktion mit Integrinen, welche für die Zelladhäsion wichtig sind. Eine offensichtliche Möglichkeit für YSK1, die Zellmigration zu beeinflussen, bestände demnach darin, die 14-3-3-abhängige Modulation der Zelladhäsion zu regulieren.
Schließlich ist gezeigt worden, dass 14-3-3-Proteine in der Qualitätskontrolle im ER, die die Bildung und den Transport multimerer Membranproteine vom ER zum Golgi-Apparat reguliert, eine Rolle spielen. Diese Funktion könnte eine weitere Möglichkeit für YSK1 darstellen, auf die Funktion des Golgi-Apparates maßgeblich Einfluss zu nehmen. Welcher dieser Mechanismen genau für die Funktion von YSK1 von Bedeutung ist, wird eine weitere Charakterisierung von 14-3-3ζ-Interaktionspartnern und YSK1-Regulatoren erfordern.
ii.i Die zentrale Spindelregion und die Kontrolle der Zytokinese
Wenn in der Anaphase die Chromosomen auf die beiden Spindelpole verteilt werden, ordnet sich eine Ansammlung ineinander greifender Mikrotubuli, die so genannte "Zentralspindel", entlang der langen Spindelachse an. Diese Struktur spielt eine wichtige Rolle dabei zu bestimmen, wo genau die Zelle sich teilen wird, und dementsprechend finden sich mehrere Proteine mit wichtigen Funktionen in der Zellteilung genau hier. Unter diesen Proteinen befinden sich auch die "Polo-like kinase", Plk1, und die so genannten "Chromosomalen Passenger Proteine". "Chromosomal Passenger Proteine" sind eine Gruppe von Proteinen, die für die Koordination der Chromosomenaufteilung mit der Zytokinese von Bedeutung sind. Sie befindet sich während der Metaphase an den Kinetochoren und wird dann in der Ana- und Telophase an die Zentralspindel wandern. Störungen in der Funktion dieser Proteine führen zu Fehlern in der Anordnung der Metaphase-Chromosomen, der Chromosomenaufteilung und der Zytokinese.
Polo-Kinasen wurden zuerst in der Fruchtfliege Drosophila melanogaster als Mutanten mit zahlreichen Defekten sowohl in der Bildung der mitotischen Spindel als auch der Zytokinese beschrieben. Seitdem sind diese Kinasen auch in den meisten anderen Eukaryonten gefunden worden, wo sie ebenfalls eine Rolle in der Zelteilung spielen. Wir haben uns bemüht zu verstehen, wieso die Lokalisierung menschlicher Plk1 während der Anaphase auf die Zentralspindel beschränkt bleibt und wie diese Kinase dort zur Regulierung der Zytokinese beiträgt. Um dies zu bewerkstelligen, haben wir die Funktion des "mitotic kinesin-like protein", Mklp2, das ebenfalls in der Anaphase an die Zentralspindel bindet und eine unentbehrliche Rolle in der Anaphase spielt, analysiert. Diese Arbeit zeigt, dass Mklp2 ein Substrat und Bindungspartner für Plk1 ist und nötig ist, um Plk1 in der Anaphase an die Zentraspindel zu binden.
Die räumliche Kontrolle von mitotischen Kinasen gewinnt zunehmend an Bedeutung für die Regulierung vieler Ereignisse während der Zellteilung. Mithilfe unserer Daten lässt sich ein Modell für die räumliche Begrenzung des Plk1-Signals auf die Zentralspindel während der Zytokinese aufstellen. Unsere derzeitigen Projekte sind darauf hin gerichtet herauszufinden, genau welche Plk1-Substrate für die Zytokinese benötigt werden.
ii.ii Regulation der "Passenger" Proteine durch mitotische Kinesine
Die Kinase Aurora B, INCENP und Survivin sind wichtige "Passenger" Proteine. INCENP fungiert als ein Strukturprotein, das Aurora B bindet und aktiviert, während Survivin anscheinend die Kinaseaktivität von Aurora B reguliert. In Saccharomyces cerevisiae wird die Loslösung des Aurora B-INCENP-Komplexes von den Kinetochoren beim Übergang von der Metaphase zur Anaphase durch die CDC14-Phosphatase kontrolliert, die INCENP dephosphoryliert und somit seine Bindung and die Spindelmikrotubuli in der Anaphase ermöglicht. Dieser Mechanismus ist höchstwahrscheinlich konserviert, da Phosphatasen der CDC14-Familie sich in allen Eukaryontischen Organismen finden lassen und diese außerdem schon mit der Regulation der Zytokinese in Caenorhabditis elegans Embryonen und sich teilenden menschlichen Zellkulturzellen in Zusammenhang gebracht wurden. Allerdings ist dies nicht der einzige Mechanismus, der die Lokalisierung des Aurora B-INCENP-Komplexes in höheren Eukaryonten kontrolliert. Depletion des ZEN-4-Proteins, das Homolog des humanen mitotischen Kinesine Mklp1/CHO1, führt zum Abfallen der Aurora B-Kinase von der Zentralspindel in C. elegans und in vitro können diese beiden Proteine auch miteinander interagieren. Die Situation ist wahrscheinlich noch komplizierter in Vertebraten, da diese zwei mitotische Kinesine besitzen, Mklp1 und Mklp2.
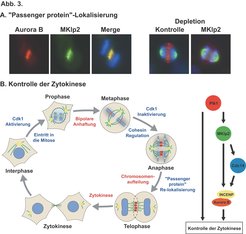
Vor kurzem haben wir in Kollaboration mit der Gruppe von Professor Nigg die unterschiedlichen Rollen von Mklp1 und Mkp2 in der Lokalisierung von Aurora B in der Anaphase untersucht. Zusammen mit unserer vorherigen Studie betreffend Mklp2, hat diese neue Arbeit sowohl einen konservierten Mechanismus als auch einen grundlegenden Unterschied zwischen dem menschlichen Zellteilungsapparat und dem von Invertebraten wie D. melanogaster und C. elegans offen gelegt. In mehreren Studien an C. elegans ist das Mklp1-Homolog ZEN-4 als ein wichtiger und für die Zytokinese unentbehrlicher Bestandteil der Zentralspindel identifiziert worden. Der Hauptbindungspartner von ZEN-4, CYK-4, kontrolliert die Aktivität von Rho-GTPasen in der Zytokinese. Dieser Komplex ist in humanen Zellen konserviert und scheint eine ähnliche Funktion zu haben. In D. melanogaster wird das Mklp1-Homolog Pav benötigt, um die Polo-Kinase zur Zentralspindel zu bringen, Defekte in einer der beiden Komponenten führen zum Versagen der Zytokinese. In menschlichen Zellen jedoch gibt es im Gegensatz zu Invertebraten zwei mitotische Kinesine mit klar abgegrenzten Rollen. MKlp1 wird benötigt, um das Rho-GAP-Protein hsCyk-4 an die Zentralspindel zu bringen, wo es die Zytokinese reguliert, während Mklp2 für die Lokalisierung der Polo-Kinase Plk1 notwendig ist. Unsere neuesten Experimente zeigen außerdem, dass Mklp2 auch gebraucht wird, um den Aurora B-INCENP-Komplex von den Zentromeren an die Zentralspindel in der Anaphase zu transportieren (Abb. 3A). Diese Ergebnisse stehen im Einklang mit früheren Studien, die einerseits zeigten, dass die Loslösung des Aurora B-INCENP-Komplexes von den Zentromeren während des Übergangs von der Meta- zur Anaphase ein Mikrotubuli-abhängiger Prozess ist und andererseits vorschlugen, dass die Chromosomen die Mikrotubuli mit Faktoren versorgen, die die Zytokinese fördern. Offensichtliche Kandidaten für diese Faktoren sind chromosomale Passenger Proteine wie Aurora B-INCENP und Plk1. Wir konnten zeigen, dass wenn kein Mklp2 vorhanden ist, die Zellteilungsfurche nicht ausgebildet wird und die Zytokinese nicht stattfindet und sowohl der Aurora B-INCENP-Komplex als auch Plk1 beide nicht korrekt während der Ana- und Telophase lokalisiert werden können. Aus diesem Grunde haben wir ein Modell entwickelt, das besagt, dass Mklp2 an der Mikrotubuli-abhängigen Lokalisierung von Plk1, Aurora B und Cdc14A an die Zentralspindel während der Anaphase beteiligt ist, und dass die Integration der Signalisierungsprozesse durch diese Proteine für eine geregelte Zytokinese notwendig ist (Abb. 3B).
Unsere derzeitige Arbeitshypothese besteht darin, dass Mklp2 sowohl notwendig ist für die frühen Ereignisse, die die Position der Zellteilungsebene festlegen, als auch für die Koordination der Zytokinese mit der Chromosomenaufteilung. Unsere zukünftigen Projekte werden sich damit beschäftigen herauszufinden, wie genau Aurora B-INCENP und Plk1 diese Ereignisse kontrollieren.