Forschungsbericht 2013 - Max-Planck-Institut für Kognitions- und Neurowissenschaften
Auditive Verarbeitung im Gehirn: Dynamische Anpassung an die akustische Umwelt
Auditory processing in the brain: Dynamic adaptation to the acoustic environment
Flexibilität auditiver Wahrnehmung
Tagtäglich befinden wir uns in wechselnden akustischen Situationen. So sitzen wir beispielsweise im Café und hören den Erzählungen eines Freundes zu oder wir stehen vor einer Konzertbühne und nehmen die Gespräche der Menschen neben uns wahr. Ob laute Hintergrundgeräusche oder Stille: Trotz der Vielzahl verschiedener Situationen, in denen wir akustischen Signalen begegnen, haben wir selten Schwierigkeiten, jemandem beim Sprechen zuzuhören, Musik wahrzunehmen, oder – allgemeiner – zu einer stabilen auditiven Wahrnehmung zu gelangen.
Unsere Fähigkeit zu hören stellt sich also flexibel auf verschiedenste Situationen ein und ermöglicht es uns, an vielen Kontexten teilzunehmen. Worauf basiert diese Flexibilität beim Hören? Sind wir aktiv daran beteiligt? Oder ist es vielleicht ein automatischer Prozess, den die Biologie für uns bereitstellt? Fragen dieser Art führen schnell zu jenem Organ, das für einen Großteil unseres Menschseins Mitverantwortung trägt: dem Gehirn. Im Folgenden werden Forschungsergebnisse dargelegt, die darauf hindeuten, dass vor allem jene Hirnprozesse erstaunlich dynamisch sind, denen man bisher nur eine empfangende (sensorische) Funktion zugeschrieben hat.
Prozesse innerhalb des Gehirns können mithilfe der Elektroenzephalografie (EEG) oder der Magnetenzephalografie (MEG) gemessen werden. Beide Messverfahren nutzen die elektrische Aktivität von Nervenzellen (Neuronen). Das EEG-Verfahren misst direkt die elektrische Aktivität der Neuronen. Mit der MEG-Messung wird das Magnetfeld gemessen, das durch die elektrische Aktivität der Neuronen im Gehirn erzeugt wird. Die so gemessene neurale Aktivität lässt sich grob in zeitlich begrenzte (transiente) und sich rhythmisch wiederholende (oszillatorische) Aktivität einteilen. Beide Formen neuraler Aktivität spielen eine wichtige Rolle im Gehirn.
Akustisch-spektraler Bereich beeinflusst neurale Sensitivität
Das in elektrische Nervensignale umgewandelte akustische Signal wird in unterschiedlichen Arealen des Gehirns verarbeitet. Die dabei am frühsten aktiven Areale werden klassisch als sensorische, das heißt als empfangende Areale bezeichnet; man spricht auch von auditiv-sensorischen Arealen. Diese Sichtweise, welche die Nervenzellen in bezeichneten Arealen als vorrangig rezipierend und statisch auf bestimmte Sinnesreize reagierend beschreibt, gilt inzwischen als überholt. Vor allem die Forschung mit Tieren hat dazu beigetragen, diese Auffassung durch eine neue Sichtweise abzulösen [1,2].
Bekannt ist, dass Neuronen bevorzugt auf bestimmte Stimulation, wie zum Beispiel einen bestimmten Bereich von Tonlautstärken oder Tonfrequenzen, reagieren. Dieses Phänomen wird „neurale Sensitivität“ genannt. In jüngeren Studien ist beobachtet worden, dass sich die neurale Sensitivität in Abhängigkeit des präsentierten Stimulationskontextes für kurze Zeit verändert. Man spricht hier von Kurzzeit-Plastizität; diese konnte nun auch für das menschliche Gehirn nachgewiesen werden.
In einem relativ einfachen Experiment wurde Probanden akustische Stimuli präsentiert, während sie sich auf einen Film konzentrierten und die akustischen Stimuli ignorierten [3,4]. In einem Versuchsdurchlauf wurden den Teilnehmern während des Filmschauens Töne verschiedener Frequenzen einer schmalen Frequenzspanne eingespielt. In einem zweiten Durchlauf wurden ihnen dann Töne über eine wesentlich breitere Frequenzspanne (Abb. 1A, 1B) präsentiert. Während der Tonpräsentation wurden EEG-Signale aufgezeichnet.
Die stärkste Variation im transienten EEG-Signal konnte um etwa 100 Millisekunden nach dem Beginn eines Tons beobachtet werden. Die Quelle dieser Gehirnantwort ist in der Hörrinde, dem auditiven Kortex, lokalisiert [5]. Die neuralen Antworten auf die Töne waren dabei stärker (das heißt negativer) für Tonfrequenzen am Rand der akustischen Stimulation. In der Abbildung ergibt sich dadurch eine U-Form (Abb. 1C, 1D).
Darüber hinaus konnten Veränderungen in der neuralen Sensitivität beobachtet werden, was sich in der Abbildung an der flacheren U-Form für akustische Stimulation mit breiter Frequenzspanne, verglichen mit der schmalen Frequenzspanne, ablesen lässt (Abb. 1D).
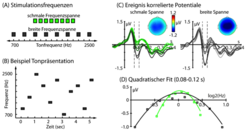
Die Ergebnisse belegen, dass sich die neurale Sensitivität von Nervenzellen automatisch an die Stimulation anpasst. In einem Umfeld mit akustisch umgrenztem Frequenzbereich reagieren Nervenzellen also ausnehmend sensitiv auf einen schmalen Bereich. In einem Umfeld mit akustisch weitem Frequenzbereich dagegen reagieren Nervenzellen besonders sensitiv auf einen breiten Bereich. Das bedeutet, dass Nervenzellen, obwohl sie in ihrer neuralen Sensitivität begrenzt sind, ihre Sensitivität an die Umwelt anpassen, sodass verschiedene Kontexte gleichartig im Gehirn abgebildet werden.
Dynamische Anpassung neuraler Aktivität an akustischen Rhythmus
Die neurale Aktivität in der Hörrinde verändert sich nicht nur abhängig von der Frequenzspanne, sondern passt sich auch an rhythmische Strukturen der akustischen Umwelt an. Solche begegnen uns etwa in Sprache oder Musik. Dabei sind es vor allem die neuralen Oszillationen in der Hörrinde, die mit den rhythmischen Strukturen der Umwelt interagieren.
Experimentell konnte diese Interaktion nachgewiesen werden, indem man Probanden rhythmische und nicht rhythmische Stimuli präsentierte und die neuralen Aktivitäten mittels EEG und MEG aufzeichnete.
Die im EEG/MEG gemessenen neuralen Oszillationen synchronisierten sich mit dem Rhythmus des akustischen Signals („neurales Entrainment“). Die neurale Aktivität oszillierte also mit dem gleichen Rhythmus wie das akustische Signal. In einem sogenannten Amplitudenspektrum, das die Aktivierungsstärke neuraler Oszillationen in verschiedenen Frequenzbändern abbildet, zeigt sich dies als eine deutliche Zunahme neuraler Aktivität in jener Frequenz, die dem Rhythmus des akustischen Signals entspricht. Abbildung 2 veranschaulicht dies im Vergleich mit rhythmusfreier Stimulation [6,7].
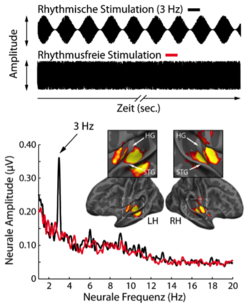
Abb. 2: Oben: akustischer Kurvenverlauf für rhythmische Stimulation (von 3 Hz) und rhythmusfreie Stimulation; unten: neurales Amplitudenspektrum, gemessen mittels EEG, während Probanden die Stimulation hörten. Es zeigt die Stärke der Gehirnaktivität für jede neurale Oszillationsfrequenz. Die rhythmische 3-Hz-Stimulation erzeugt auch im Gehirn starke Aktivität bei 3 Hz, die in der Hörrinde lokalisiert ist.
Die Synchronisation neuraler Oszillationen mit akustischen Rhythmen beeinflusst auch die menschliche Wahrnehmung. Beispielsweise stehen Veränderungen in der Synchronisationsstärke in der Hörrinde im Zusammenhang mit der Wahrnehmung der Geschwindigkeit von akustischen Sequenzen und Rhythmen [7]. Darüber hinaus beeinflusst die mit dem akustischen Rhythmus synchronisierte neurale Aktivität, ob wir schwache Umweltreize wie einen Ton im Rauschen oder ein nur schwer sichtbares Bild bemerken oder nicht [8].
Fazit: Die Dynamik von Gehirnaktivität
Aus diesen beispielhaften Studien lässt sich schließen, dass gleichartige, unveränderte Umweltreize die neurale Aktivität nicht notwendigerweise prototypisch und in immer gleicher Art und Weise beeinflussen. Nervenzellen zeigen natürliche Präferenzen für bestimmte akustische Signale – doch wie sensitiv genau Zellen auf diese Signale reagieren, hängt weitgehend vom akustischen Kontext ab.
Vermutlich ist es genau diese dynamische Ultra-Kurzzeit-Plastizität des Gehirns, die es uns ermöglicht, flexibel auf verschiedene Situationen gleichwertig zu reagieren. Prozesse der Aufmerksamkeit wiederum können Mechanismen der Biologie beeinflussen und unterstreichen damit zusätzlich die Flexibilität und Dynamik, mit der Biologie und Umwelt interagieren.

