Forschungsbericht 2005 - Max-Planck-Institute für biophysikalische Chemie
Der JAK/STAT-Signalübertragungsweg
The JAK/STAT signalling pathway
Die Hauptfunktion der JAK/STAT-Übertragungskaskade ist es, durch ein extrazelluläres Signal die Expression von spezifischen Zielgenen zu ermöglichen. Die wichtigsten Komponenten dieses Übertragungsweges sind extrazelluläre Liganden, ein Transmembran-Rezeptor und eine an den Rezeptor gekoppelte Tyrosin-Kinase, bekannt als Janus-Kinase (JAK). Nach der Anbindung des Liganden an den extrazellulären Teil des Rezeptors führen Konformationsänderungen zu einer Aktivierung der assoziierten JAK, die zuerst sich selbst und dann den Rezeptor phosphoryliert und damit eine Andockstelle für „Signal Transducer and Activator of Transcription (STAT)“-Moleküle erzeugt. STAT-Moleküle können an diese Andockstelle binden, werden ebenfalls durch JAK phosphoryliert, bilden Dimere und wandern zum Zellkern. Im Kern binden die aktivierten STAT-Dimere dann an regulatorische DNA-Sequenzen der Zielgene und bewirken so ihre Expression (Abb. 1).
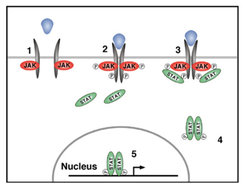
Die Hauptkomponenten des JAK/STAT-Signalübertragungsweges sind im Verlauf der Evolution in allen Wirbeltieren und Insekten, die man bisher daraufhin untersucht hat, erhalten worden. Während beim Menschen und bei der Maus jeweils sieben unterschiedliche STAT- und vier unterschiedliche JAK-Moleküle gefunden wurden, besitzt die Taufliege Drosophila melanogaster jeweils nur ein JAK- und ein STAT-ähnliches Molekül. Insoweit ist der Drosophila-Übertragungsweg entsprechend weniger komplex aufgebaut und einer Analyse leichter zugänglich. Die Göttinger Forscher verwenden deshalb Drosophila als Modellsystem und machen sich dabei dessen vereinfachten JAK/STAT-Signalübertragungsweg zunutze. Außerdem greifen sie auf ein Repertoire ausgefeilter genetischer Methoden zurück, mit denen Gene und ihre Interaktionen untersucht werden können. Sie setzen verschiedene genetische Techniken ein, um die Komponenten und Regulatoren des JAK/STAT-Signalübertragungsweges zu identifizieren und zu charakterisieren. Dabei verwenden die Wissenschaftler die bereits bekannten Entwicklungsfunktionen des Übertragungsweges als Hilfsmittel zur Untersuchung der Funktion der beteiligten Moleküle in vivo.
Genetische Screens
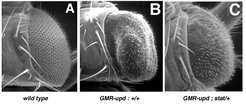
Zeidler und sein Team haben eine Reihe genetischer Screens durchgeführt, um Gene zu identifizieren, die mit dem JAK/STAT-Signalübertragungsweg interagieren. Zu den Techniken gehören sowohl klassische genetische Screens, bei denen zufällig erzeugte Mutanten auf ihre Interaktionen mit dem Signalübertragungsweg getestet wurden, als auch genetische Screens unter Zuhilfenahme der so genannten „Reversen Genetik“, bei denen in Zellkultur mittels der RNAi-Technologie Gene systematisch ausgeschaltet werden. Für den ersten Ansatz haben die Forscher 2267 unabhängig voneinander erzeugte Fliegenmutanten, die von Dr. Ulrich Schäfer (Max-Planck-Institut für biophysikalische Chemie, Göttingen) zur Verfügung gestellt wurden, daraufhin getestet, ob sie mit einer genetisch modifizierten Fliegenlinie (GMR-upd) interagieren. In den sich entwickelnden Augen der GMR-upd-Fliegen wird ein Ligand des JAK/STAT-Signalübertragungsweges vermehrt exprimiert, was Zellwucherungen innerhalb der Augen-Anlage zur Folge hat. Dies führt zu übersteigertem Wachstum der Augen im Vergleich zu Wildtyp-Fliegen (Abb. 2 A, B). Für einen genetischen Screen ist es wichtig, dass das Ausmaß des GMR-upd-induzierten Augenwachstums mit der Stärke der JAK/STAT-Signalübertragung korreliert. So zeigen Fliegen, die sowohl ein GMR-upd-Transgen als auch eine Mutation in einer Kopie des Drosophila-stat-Gens enthalten, deutlich geringeres Augenwachstum als solche Fliegen mit zwei intakten stat-Genen (vergleiche Abb. 2 B und C). Tina Mukherjee hat die erzeugten Mutanten getestet und dabei 23 Fliegenstämme identifiziert, die Interaktionen mit GMR-upd zeigen. Darunter befanden sich Komponenten von drei anderen Signalübertragungswegen, sieben potenzielle Komponenten des JAK/STAT-Signalübertragungsweges selbst und sechs Zielgene, deren Expression im sich entwickelnden Auge von STAT beeinflusst wird.
Für einen zweiten Screen hat die Arbeitsgruppe Techniken der Reversen Genetik verwendet. Im Rahmen der fruchtbaren Zusammenarbeit mit dem Labor von Dr. Michael Boutros (Deutsches Krebsforschungszentrum, Heidelberg) haben die Göttinger eine Bibliothek doppelsträngiger RNA-Moleküle (dsRNA) verwendet, die jedem einzelnen Gen des Drosophila-Genoms entsprechen. Die Zugabe von dsRNA zu kultivierten Drosophila-Zellen kann die Proteinproduktion von Zielgenen drastisch und spezifisch vermindern. Somit kann dsRNA die Aktivität spezifischer Gene „abschalten“.
Patrick Müller unternahm den ersten „Genom-umfassenden“ Screen für Gene, die für den JAK/STAT-Signalübertragungsweg erforderlich sind, indem er fast 22.000 dsRNAs in einem STAT-abhängigen Testverfahren verwendete. Unter den identifizierten Proteinen befanden sich sowohl bereits bekannte als auch völlig neue Proteine. Ein Beispiel ist das Drosophila-Homolog des menschlichen BRWD3-Gens, das für die Aktivität von STAT notwendig ist. Außerdem findet man bei zahlreichen Patienten mit chronischer lymphozytischer Leukämie Mutationen in diesem Gen. Hiermit übereinstimmend sind auch Beobachtungen bei einem Drosophila-Modell für Leukämie, bei dem durch die Entfernung einer Kopie von BRWD3 die Häufigkeit und Schwere von Blutzelltumoren abnimmt (Abb. 3).

Analyse neuer JAK/STAT-Regulatoren
Drosophila bietet nicht nur ein ausgezeichnetes System zur Identifizierung neuer Komponenten eines Signalübertragungsweges. Die Taufliege ist auch ein für die Analyse von Genfunktionen besonders gut geeigneter Organismus. So wurde insbesondere die Entwicklungsbiologie der Taufliege über viele Jahre hinweg intensiv studiert. Mittlerweile besitzen die Wissenschaftler exzellente Kenntnisse darüber, welche entwicklungsbiologischen, morphologischen und zellbiologischen Erfordernisse erfüllt sein müssen, damit aus einem frisch gelegten Drosophila-Ei eine adulte Fliege entstehen kann. Diese Kenntnisse hat das Team um Zeidler genutzt, um die Funktionen zahlreicher wichtiger Moleküle zu untersuchen. Dies betrifft zum einen das STAT-Molekül selbst und zum anderen den Ken&Barbie-Locus, bei dem die Forscher die Regulation von Zielgenen untersucht haben, die normalerweise durch den JAK/STAT-Signalübertragungsweg aktiviert werden.
Wie oben erwähnt, reicht die Aktivierung des JAK/STAT-Signalübertragungsweges im sich entwickelnden Auge aus, um eine Form von Vorläuferzellen zu bewirken, die schließlich zu übermäßigem Wachstum des adulten Auges führt (Abb. 2 B). Außerdem wurde gezeigt, dass die Aktivierung des Signalübertragungsweges in Blutzellen Leukämie-ähnliche Tumoren verursachen kann (Abb. 3 A), während ein Abschalten des Signalübertragungsweges zu einer reduzierten Proliferation und kleinen oder fehlenden adulten Vorläuferzellen führt. Um die Rolle von STAT bei der Kontrolle zellulärer Proliferation zu untersuchen, führte Tina Mukherjee eine Reihe eleganter Experimente durch. Dabei wurde STAT im Verlauf der Flügelentwicklung in kleinen Zellgruppen entweder entfernt oder überaktiviert. Indem sie Wachstum und Proliferation dieser mutanten Zellen untersuchte und quantifizierte, konnte sie eine unerwartete Dynamik und eine duale Rolle für STAT bei der Regulation der zellulären Proliferation während der Entwicklung feststellen.
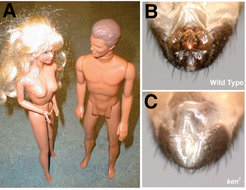
Schließlich hat die Arbeitsgruppe auch die Analyse des Drosophila-Gens Ken&Barbie (Ken) durchgeführt. Wie es bei Drosophila-Genen üblich ist, wurde dieser Locus nach seinem mutanten Phänotyp benannt: Die adulten Fliegen zeichnen sich durch einen vollständigen Verlust externer Genitalien aus – ein Schicksal, das sie mit ihren Namensvettern aus Plastik teilen (Abb. 4). Zusätzlich zu dieser entwicklungsbiologischen Funktion stellte sich heraus, dass Ken-Mutationen Modulatoren des GMR-upd-Augenphänotyps darstellen. Im Verlauf ihrer Doktorarbeit im Labor von Martin Zeidler hat Natalia Arbouzova die molekulare Grundlage dieser genetischen Interaktion sorgfältig untersucht. Sie zeigte, dass das Ken-Protein zwei Funktionen besitzt, zum einen als transkriptioneller Repressor und zum anderen als Sequenz-spezifisches DNA-bindendes Molekül. Sie konnte weiter zeigen, dass Ken mit dem JAK/STAT-Signalübertragungsweg interagiert, indem es selektiv an solche DNA-Sequenzen bindet, die normalerweise durch STAT besetzt werden. Auf diese Weise verhindert die Bindung von Ken die Aktivierung einer Gruppe von Zielgenen, die sonst als Reaktion auf die JAK/STAT-Signalübertragung aktiviert werden. Interessanterweise haben die Experimente auch zeigen können, dass Ken ein funktionelles Homolog des menschlichen BCL6-Gens darstellt, dessen Locus bei zahlreichen Nicht-Hodgkin-Lymphompatienten mutiert ist. Obwohl diese Verbindung noch nicht weiter untersucht wurde, ist es möglich, dass die Arbeit mit dem Drosophila-Modellsystem einige grundlegende Mechanismen aufhellen wird, die bei dieser schweren Krankheit des Menschen zum Tragen kommen.
Danksagungen
Die Arbeit wurde mit finanzieller Unterstützung des Emmy-Noether-Programms der Deutschen Forschungsgemeinschaft und der Max-Planck-Gesellschaft durchgeführt. Ich danke den im Bericht genannten Wissenschaftlern meines Labors ebenso wie meinen Mitarbeitern Peter Karsten, Samira Bina, Oscar-Marino Vidal, Sabine Häder und Iris Plischke, die in äußerst wertvoller Weise zum Gelingen dieser Projekte beigetragen haben.



