Forschungsbericht 2008 - Max-Planck-Institut für Biochemie
Strukturelle Untersuchungen der Dynamik von Virus-Zell-Interaktionen
Zelluläre Infektion durch Viren (Grünewald, Abteilung Molekulare Strukturbiologie, DFG/Emmy Noether) (Dr. Kay Grünewald)
MPI für Biochemie, Martinsried
Virusuntersuchungen mittels Kryo-Elektronentomographie
Viren können sich nicht selbstständig vermehren, sondern müssen Wirtszellen infizieren und deren Stoffwechsel umprogrammieren, damit diese viele neue Viren produzieren und freisetzen. Während einer Infektion heftet sich das Virus an die Wirtszelle, dringt in diese ein und setzt bestimmte Faktoren sowie seine genetische Information (DNA oder RNA) gezielt in der Zelle frei. Dies führt dazu, dass zelluläre Prozesse in der Wirtszelle auf die Virusvermehrung ausgerichtet werden, ohne aber die Wirtszelle vorzeitig zu zerstören.
Die Forschungsgruppe konzentriert sich primär auf das humane Herpes Simplex Virus 1 (HSV-1) als Modell. Das Virus ist der Prototyp der Familie der Herpesviridae, die nicht nur die bekannten Herpes-Bläschen am Mund hervorrufen, sondern neben Windpocken, Gürtelrose und Karzinomen für mehr als 60 verschiedene Krankheitsbilder bei Mensch oder Tier verantwortlich sind. Herpesviren etablieren sich nach einer Infektion lebenslang im Organismus und können immer wieder erneut zum Ausbruch von Krankheitssymptomen führen. Studien zum detaillierten Ablauf des Infektionsvorgangs und zum „Lebenszyklus“ des Virus bei einer Auflösung im makromolekularen Bereich waren im nativen Zustand bisher nicht möglich. Sie sind jedoch Voraussetzung für ein umfassendes Verständnis der komplexen Interaktionen zwischen Virus und Wirtszelle und so langfristig auch Grundlage für neue Therapieansätze. Darüber hinaus erlauben Untersuchungen der viralen Interaktionen auch vielfältige neue Einblicke in die Struktur, Organisation und Funktion der Zelle [1].
Für die Studien wurde die am Max-Planck-Institut für Biochemie in der Abteilung von Wolfgang Baumeister maßgeblich mitentwickelte Technik der Kryo-Elektronentomographie (Kryo-EM) eingesetzt ([2]; vergleiche Tätigkeitsbericht des Max-Planck-Instituts für Biochemie: Hochauflösende Mikroskopie von Zellen und Oberflächen: Kryo-Elektronentomographie und Raster-Infrarotmikroskopie im optischen Nahfeld (Jahrbuch der Max-Planck-Gesellschaft, 2005). Die Technik wurde soweit vorangetrieben, dass sie mittlerweile im Nanometerbereich eingesetzt werden kann und damit die Lücke zwischen der Lichtmikroskopie dynamischer Vorgänge in lebenden Zellen und höchstauflösenden Strukturen, zum Beispiel aus der Röntgenkristallographie, schließt. Die Technik erlaubt dreidimensionale Einblicke in zelluläre Vorgänge bei molekularer Auflösung, und es können große Molekülkomplexe oder Zellstrukturen sowie ihre Interaktion und Organisation in der Zelle unter natürlichen Bedingungen untersucht werden. Dazu werden die Proben im nativen Zustand bei circa -180 °C schockgefroren. Der Vitrifizierung genannte Gefriervorgang erfolgt innerhalb von Millisekunden und schließt so die Bildung von Eiskristallen aus, die die Mikroarchitektur der Probe zerstören würden. Zur nachfolgenden Untersuchung der mit flüssigem Stickstoff gekühlten Probe im Elektronenmikroskop ist keine weitere Fixierung oder Kontrastierung notwendig. Somit besteht nicht die Gefahr der Veränderung des natürlichen Zustandes und das Objekt kann unverfälscht untersucht werden. Die Probe wird im Elektronenmikroskop computergesteuert rotiert. Dadurch wird die Aufnahme einer Vielzahl von Einzelbildern in so genannten Kippserien über einen Bereich von etwa +/- 65° ermöglicht, die mit einer hochauflösenden CCD-Kamera dokumentiert werden. Spezielle Computerprogramme erlauben die Rückprojektion der Einzelbilder in dreidimensionale Aufnahmen, die Aussagen über die Organisation des Objekts zulassen (Abb. 1).
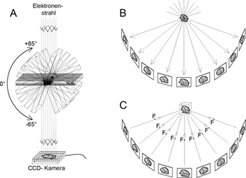
Der Aufbau des Herpes-Simplex-Virus
HSV-1 ist ein relativ komplex gebautes Virus; im Jahr 2003 wurde eine erste dreidimensionale Rekonstruktion der Gesamtstruktur infektiöser Partikel veröffentlicht ([3], Abb. 2). Das 180-220 nm große DNA-Virus besteht aus Tausenden von Einzelmolekülen. Die DNA wird von einer als Kapsid bezeichneten, ikosaedrischen Proteinhülle beherbergt. In Kooperation mit Alasdair Steven (National Institutes of Health, Bethesda, USA) und gemeinsam mit der Abteilung von Wolfgang Baumeister konnte damals gezeigt werden, dass die das Kapsid umgebende Schicht - das so genannte Tegument - eine asymmetrische Kappe um das Kapsid bildet. Die Feinstruktur des Teguments erscheint als ein dichtes, partikuläres Netzwerk. Es bildet an einer Seite eine etwa 35 Nanometer dicke Schicht zwischen Kapsid und Membranhülle, während das Kapsid an der gegenüberliegenden Seite in direktem Kontakt mit der viralen Hüllmembran steht. Das Kapsid hat somit in den Herpes-Partikeln eine außermittige Position und ist mit dem Tegument an den Ecken des Ikosaeders verbunden. Dieser Befund erlaubte zudem Rückschlüsse auf den Zusammenbau der Viruspartikel in der Zelle.
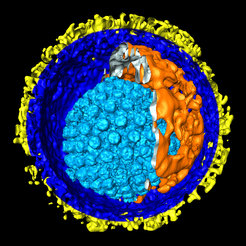
In der Hüllmembran des Herpesvirus gibt es mehr als zwölf verschiedene Glykoproteine in einer Vielzahl von Kopien. Die kryo-elektronentomographischen Daten zeigten, dass einige dieser Glykoproteine als Fortsätze (Spikes) mit unterschiedlicher Form und Länge aus der Membran herausragen und auch mit dem Tegument über die Hüllmembran hinweg verbunden sind. Dies ist möglicherweise die Ursache der gefundenen ungleichen Verteilung der circa 650 Spikes auf der Virusmembran. Daraus ergibt sich für das Virus eine Polarität, die beim Zelleintritt von Bedeutung sein könnte.
Der Infektionsvorgang im Detail
Nach den indirekten Schlüssen zur Interaktion des Virus mit der Wirtszelle aus der Auswertung von Daten isolierter Viruspartikel lag der Schwerpunkt der Arbeiten im Folgenden auf der direkten Untersuchung der Virus-Zell-Interaktionen. Untersucht wurde zunächst die Anheftung und der Zelleintritt der Viren in tierische und menschliche Zellen [4]. Dabei konnten verschiedene Stadien unmittelbar nach der Verschmelzung der proteinreichen Membranhülle des Virus mit der Membran der Wirtszelle beobachtet werden. Anhand der charakteristischen ikosaedrischen Form der Viruskapside konnten diese in den Rekonstruktionen sehr gut von dem sie umgebenden Zytoskelett der infizierten Zelle unterschieden und die Interaktionen beschrieben werden (Abb. 3).
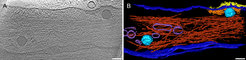
Für die detaillierte Analyse der einzelnen Schritte des Infektionsprozesses wurde in Zusammenarbeit mit Beate Sodeik (Medizinische Hochschule Hannover) ein anderes Wirtssystem gewählt, da man in intakten Zellen auf Grund der begrenzten durchstrahlbaren Probendicke an die flachen Bereiche der Zellperipherie gebunden ist. Benutzt wurden so genannte Synaptosomen, das sind isolierte Nerven-Enden, über die Nervenzellen miteinander kommunizieren. Aus früheren Studien war bekannt, dass Synaptosomen für Studien von HSV-1-Infektionen geeignet sind. Das Schockgefrieren der Synaptosomen erfolgte zu verschieden Zeiten nach Zugabe der Viren. Aus der Vielzahl der Einzelbeobachtungen in den elektronentomograpischen Rekonstruktionen war es möglich, die zeitliche und räumliche Abfolge des Infektionsvorgangs als dynamischen Prozess mit einer bisher noch nie erreichten Genauigkeit zu dokumentieren [4]. Nach der Anheftung des Virus verschmilzt – analog zu den Beobachtungen für den Eintritt in intakte Zellen – zuerst die Membranhülle des Virus mit der Plasmamembran der Synaptosomen. Dabei wird das virale Kapsid in das Zytosol freigesetzt (Abb. 4).
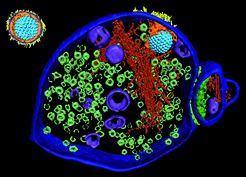
Der Hauptteil des Teguments verbleibt unmittelbar an der Eintrittsstelle, wahrscheinlich auf Grund des bereits in isolierten Viren beobachteten, direkten Transmembrankontaktes mit den Glykoprotein-Spikes. Später geht dieser Kontakt wahrscheinlich durch eine von zellulären Proteinen hervorgerufene Modifizierung der Tegumentproteine verloren. Die zunächst noch stark gewölbte Fläche der verschmolzenen Membranen mit den ausgeprägten, dicht beieinander befindlichen viralen Glykoproteinen wird flacher und die Glykoprotein-Spikes verschwinden. Trotz gezielter Suche waren Stadien der eigentlichen Membranfusion extrem selten zu beobachten. Somit kann dieser Vorgang als sehr schneller Prozess angenommen werden.
Interessanterweise scheint der asymmetrische Aufbau der Herpesviruspartikel den Infektionsvorgang zu unterstützen. Anders als zunächst erwartet, erfolgt die Fusion aber nicht an dem Pol, der am dichtesten mit Glykoprotein-Spikes besetzt ist, sondern an dem Viruspol mit weniger Spikes und mit der geringsten Menge an Tegumentproteinen. Dies ist der Bereich, in dem Viruskapsid und Hüllmembran einander am nächsten sind. Vermutet wird deshalb, dass dieser Pol des Virus für die Verschmelzung wichtig ist, während der durch eine dickere Tegumentschicht und viele Glykoprotein-Spikes charakterisierte Gegenpol eher beim Zusammenbau der Viruspartikel von Bedeutung ist. Aus den gefundenen Sequenzen des Infektionsablaufs und den beobachteten Strukturveränderungen der viralen Glykoproteine konnte ein Modell für den Eintrittsvorgang aufgestellt werden [4]. Dabei wird davon ausgegangen, dass große, sperrige Spikes in dichten Gruppen auf der Virusoberfläche nicht an der Initiierung des Verschmelzungsprozesses beteiligt sind, sondern eher als Abstandshalter fungieren. In den weniger dicht mit Glykoproteinen besetzten Bereichen der viralen Hüllmembran hingegen können kleinere Glykoproteine des Virus an ihre Rezeptoren auf der Zellmembran binden. Dies löst den weiteren Verlauf der komplexen Interaktion mehrerer Glykoproteine sowie der Plasmamembran und beteiligter Rezeptormoleküle der Wirtszelle aus. Schließlich kommt es so zur Vermischung der Membranlipide und zur Ausbildung einer Pore, gefolgt von deren Erweiterung und der Freisetzung des viralen Inhalts ins Zellinnere.
Ausblick
Die hier erläuterten Studien zum Zelleintritt bilden nur den Auftakt systematischer Untersuchungen der komplexen Interaktionen des Herpes Simplex Virus mit zellulären Strukturen im Verlauf der Infektion. Derzeitige Studien konzentrieren sich auf weitere wichtige Schritte im Infektionsvorgang wie den intrazellulären Transport der Viren, die Interaktionen der Viren mit den Kernporenkomplexen und die Vorgänge beim Viruszusammenbau im Zellinneren. Dabei liegt der Schwerpunkt nicht primär auf einer phänomenologischen Beschreibung der molekularen Details, sondern auf dem funktionellen Verständnis der Prozesse. Dazu wird die Technik der zellulären Kryo-Elektronentomographie mit geeigneten komplementären Techniken und Ansätzen kombiniert [5]. Insbesondere Untersuchungen in schrittweise reduzierten Systemen und die anschließende in vitro Rekonstitution der Vorgänge erlauben ein umfassendes Verständnis der Rolle einzelner Faktoren sowohl in diesem fein abgestimmten Zusammenspiel als auch im natürlichen, ungestörten Zellkontext.
Die Untersuchungen sind nicht allein auf HSV-1 als Modell beschränkt. Untersucht wird auch der Aspekt des Zusammenbaus und der Reifung von Viruspartikeln in Zusammenarbeit mit den Arbeitsgruppen von Hans-Georg Kräusslich (Universität Heidelberg) und Steve Fuller (University of Oxford, UK) am Beispiel des humanen Immunodefizienz Virus (HIV) [6-8]. Eine weitere Thematik ist die Strukturanalyse von Viren aus der Familie der Bunyaviridae [9, 10].



