Darmbakterien lösen postoperative Komplikationen aus
Immunzellen in der Leber kontrollieren Bakterien, wenn diese sich nach größeren Operationen ausbreiten
Bislang ging man davon aus, dass eine keimfreie Umgebung der wichtigste Faktor ist, postoperative Infektionen zu verhindern. Nun zeigt eine neue Studie eines Teams der Max-Planck-Forschungsgruppe für Systemimmunologie in Würzburg zusammen mit der Universitätsklinik Bern, dass die Gefahr offenbar aus einer ganz anderen Ecke kommt: dem Darm der Patienten.

Kliniken versuchen Infektionen nach chirurgischen Eingriffen zu verhindern, indem die Umgebung so keimfrei wie möglich gehalten wird. Dass Begleitinfektionen bei invasiven Eingriffen die Sterblichkeit erhöhen, ist seit Langem bekannt. Deshalb werden umfangreiche Sterilisationsmaßnahmen durchgeführt, um Mikroorganismen während der Operation weitgehend auszuschalten.
Die Studie der Wissenschaftler der Max-Planck-Forschungsgruppe in Würzburg und der Universitätsklinik für Viszerale Chirurgie und Medizin des Inselspitals in Bern, zeigt nun: Die Verursacher dieser Infektionen weisen eine mikrobielle Signatur des Darms auf. Bei so gut wie allen Patienten handelte es sich bei den Erregern um Darmbakterien wie beispielsweise Enterococcus, Escherichia coli und Clostridium. In der Studie analysierte das Forscherteam die Mikroorganismen, die bei fast 4.000 Patienten nach einem größeren chirurgischen Eingriff Begleitinfektionen verursacht haben.
Die Erreger überwinden offenbar postoperativ die Darmbarriere und breiten sich über den Blutstrom im Körper aus. Am häufigsten sorgen sie nach Operationen an der Leber, der Bauchspeicheldrüse und den Gallenwegen sowie bei Operationen am Dünn- und Dickdarm für Infektionen. Besonders Patientinnen und Patienten, die sich einer großen Leberresektion – also der Entfernung großer Teile der Leber – unterziehen mussten, erlitten solch eine Infektion, die den Heilungsprozess deutlich verzögerte.
Wichtige Immunzellen sitzen in der Leber

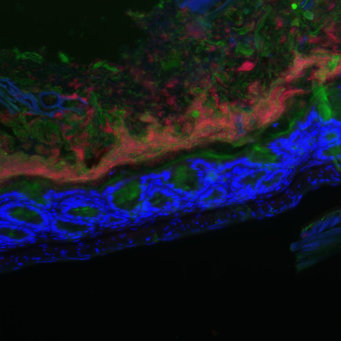
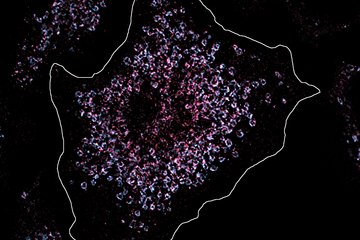
Die Wissenschaftler sind dann den Mechanismen der Infektionskontrolle bei gesunden Patienten auf die Spur gegangen: Die Leber übernimmt in diesem Infektionsgeschehen eine besondere Rolle: „Wir wissen, dass spezielle Immunzellen, die in der Leber ansässig sind, für die Kontrolle dieser sich ausbreitenden Bakterien und für den Heilungsprozess nach größeren Operationen verantwortlich sind“, sagt Mercedes Gomez de Agüero, Nachwuchsgruppenleiterin in der Max-Planck-Forschungsgruppe für Systemimmunologie. Bei ihnen handelt es sich um eine Gruppe von Lymphozyten, die sogenannten „Innate Lymphoid Cells“ (ILCs) - wichtige Akteure des angeborenen Immunsystems.
Gelangen nun über den Blutstrom Bakterien aus dem Darm in die Leber, werden diese ILCs aktiviert und setzen spezielle Botenstoffe frei, wie beispielsweise Interleukin 22, ein Protein, das Immunreaktionen auslösen und regulieren kann. Auf diese Weise regen sie Leberzellen dazu an, antimikrobielle Substanzen zu produzieren. „Damit kontrollieren in der Leber ansässige angeborene lymphatische Zellen die systemische Ausbreitung von Darmbakterien und bekämpfen wirksam Begleitinfektionen nach Operationen“, so die Wissenschaftlerin.
Wie schützt man Patienten vor Infektionen durch eigene Darmbakterien?
“Die Stärkung der Immunität stellt somit eine sinnvolle prophylaktische und therapeutische Alternativstrategie zu den üblichen antimikrobiellen Therapien dar, um Begleitinfektionen nach Operationen zu verhindern“ schlägt der Berner Mediziner Guido Beldi vor. Zumindest so lange, bis aufgeklärt ist, welche Faktoren dafür verantwortlich sind, dass Darmbakterien nach einem operativen Eingriff die Darmbarriere überwinden und in das Körperinnere eindringen können. Dieser Frage will das Forscherteam jetzt nachgehen.
Über die Max-Planck-Forschungsgruppe für Systemimmunologie
Die Max-Planck-Forschungsgruppe für Systemimmunologie ist eine gemeinsame Initiative der Julius-Maximilians-Universität Würzburg und der Max-Planck-Gesellschaft mit dem Ziel, exzellente immunologische Forschung zu fördern. Die rund 50 Forschenden aus über 20 Ländern wollen die Grundlagen für eine erfolgreiche Immunantwort gegen Infektionserreger, chronisch entzündliche Erkrankungen und Tumore verstehen, um neue Konzepte und Strategien für Impfstoffe und Immuntherapien zu entwickeln.
Dabei untersuchen sie die Entwicklung und Funktion des Immunsystems auf mehreren Ebenen: von hochauflösenden Analysen einzelner Moleküle und Zellen, über komplexe zelluläre Netzwerke innerhalb von Organen, bis hin zu den systemischen Wechselwirkungen im Körper und mit der Umwelt. Diese Forschungsziele fügen sich hervorragend in das Umfeld der international sichtbaren Forschung zu Infektionskrankheiten und Immuntherapien auf dem Würzburger Life-Science-Campus ein.