Knochenarbeit
Das Skelett gibt dem Körper Halt. Doch dieses Gerüst ist alles andere als statisch: Ständig werden Knochen erneuert und bei mechanischer Belastung umgebaut. Was dabei genau geschieht und welche Struktur die Knochen steif und fest macht, untersuchen Richard Weinkamer und Wolfgang Wagermaier am Max-Planck-Institut für Kolloid- und Grenzflächenforschung. Ihre Erkenntnisse könnten auch für die Medizin und die Materialwissenschaft relevant werden.
Text: Catarina Pietschmann

Knochenbrüche, verkrümmte Wirbelsäulen, abgenutzte Hüftgelenke – als Chirurg an der Charité hatte er einiges gesehen. Die Röntgenstrahlung war noch nicht entdeckt, als Julius Wolff 1892 das Gesetz der Transformation der Knochen formulierte. Feine Knochenschnitte, hergestellt mit einer Elfenbeinsäge und gegen das Licht gehalten, hatten ausgereicht zu erkennen, dass die feinen Bälkchen im Knocheninneren sich entsprechend der mechanischen Belastung umbauen. Form follows function, würde man heute sagen. Die Form folgt der Funktion. Bei der Knochenarchitektur ist die Designrichtlinie besonders wörtlich zu nehmen. Um Spannung abzubauen und maximale Stabilität zu erreichen, reagiert Knochen aktiv und permanent auf mechanische Reize. Und zwar so, dass in stärker belasteten Bereichen Material angebaut, in entlasteten hingegen entfernt wird. Aber wie und wodurch das ausgelöst wird, darüber rätselt die Wissenschaft auch noch 130 Jahre später.
In der Abteilung „Biomaterialien“ des Max-Planck-Instituts für Kolloid- und Grenzflächenforschung in Potsdam sind zwei österreichische Wissenschaftler mit modernsten Methoden tief in die Thematik eingestiegen – und kommen der Lösung immer näher. Der eine, Richard Weinkamer, Mathematiker und Physiker, aus Interesse an der Mechanobiologie des Knochens. Der andere, Wolfgang Wagermaier, weil er als Werkstoffwissenschaftler vom natürlichen Hybridmaterial Knochen fasziniert ist. Es geht um grundlegende Erkenntnisse, die einerseits helfen, Knochenkrankheiten besser zu verstehen, andererseits aber auch zu synthetischen Materialien mit interessanten neuen Eigenschaften führen.
Knochen bestehen aus einer an sich weichen Kollagenmatrix, in die feinste Plättchen aus Calciumphosphat eingebettet sind. Dieses Konstrukt verleiht dem Material Festigkeit und Steifigkeit – aber auch eine gewisse Elastizität. „Hybridmaterialien aus Proteinen und Mineralien wie Calciumphosphat, Calciumcarbonat, Siliciumoxid oder Eisenoxid sind in der Natur weit verbreitet. Man denke an Perlmutt, Kieselalgen oder Zähne. Oder eben an Knochen“, sagt Wagermaier. „Wären die nur ein weicher Gewebshaufen, wäre Fortbewegung gar nicht möglich. Zugleich dienen Knochen dem Körper auch als Calciumreservoir.“ Ein sehr nachhaltiges Materialmanagement also, das auch äußerst sinnvoll ist. Denn die mehr als 200 Knochen eines Erwachsenen, die etwa zehn Prozent des Körpergewichts ausmachen, sind ständig im Umbau. Über die Nahrung immer wieder neu entsprechende Mineralienmengen aufzunehmen, wäre kaum machbar.
30 Millionen Zellen pro Kubikzentimeter
Innerhalb von zehn Jahren hat sich ein kompakter Knochen wie etwa das Schienbein komplett erneuert. Bei schaumartigen Knochen wie den Wirbelkörpern dauert es sogar nur etwa fünf Jahre. Die Arbeit erledigen Bau- und Abrisskolonnen aus spezialisierten Zellen. Osteoblasten bauen Knochenmasse auf, Osteoklasten reißen sie wieder ein. 95 Prozent aller Knochenzellen sind jedoch Osteozyten. Als wären sie einer Novelle von Edgar Allan Poe entsprungen, sitzen sie Jahre, teils sogar Jahrzehnte lebendig eingemauert in kleinen Höhlen im Knochen – etwa 30 Millionen Zellen pro Kubikzentimeter. Weil sie an den Umbauprozessen nicht direkt beteiligt und in ihren Höhlen nur schwer zugänglich sind, hatten viele Forschende diesen Zelltyp lange Zeit nicht auf dem Schirm. Richard Weinkamer und Wolfgang Wagermaier interessieren sich umso mehr für sie. Denn Osteozyten haben wichtige Aufgaben, die in Potsdam durch die Kombination verschiedener optischer Methoden, materialwissenschaftlicher Charakterisierungen, mathematischer Berechnungen und Simulationen erforscht werden. Osteozyten sind zum Beispiel am Mineralhaushalt beteiligt, schütten sogar Hormone aus und dienen als Drucksensoren, wie die Forscher kürzlich herausgefunden haben.
Manche ihrer Funktionen können die Osteozyten nur ausüben, weil sie in einem knöchernen Gefängnis sitzen. Und dorthin gelangen sie durch eigenes Zutun. „An diesen Stellen haben Osteoklasten irgendwann einmal kleine Tunnel in den Knochen gefressen. Dann kamen Osteoblasten, mauerten sie Schicht für Schicht wieder zu, sich dabei selbst mit ein und differenzierten zu reifen Knochenzellen – den Osteozyten“, erklärt Richard Weinkamer.
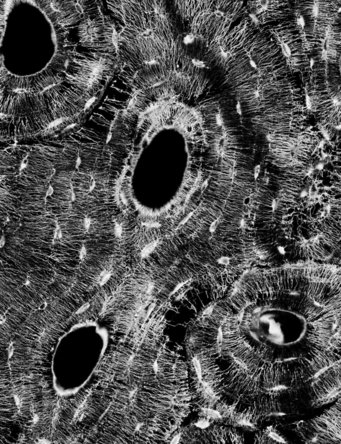
Das Netzwerk der Osteozyten

Um die eingesperrten Osteozyten zu untersuchen, sägen die Forschenden zunächst eine Probe aus einem Knochen heraus, betten sie in Kunststoff ein und betrachten sie im Elektronenmikroskop. Als Erstes fallen große dunkle Flecken auf. Es sind Kanäle, die den Knochen durchziehen und durch die Blutgefäße laufen. Sie sind umgeben von den Osteonen, konzentrischen Strukturen ähnlich den Jahresringen einer Baumscheibe und nur eine Nuance dunkler als der helle Teil der Knochenprobe. „Hier um den Blutkanal herum ist der Knochen noch jünger und weniger stark mineralisiert“, erklärt Wolfgang Wagermaier. „Die kleinen, dunklen Flecken mittendrin sind die Lakunen. Und in diesen etwa 15 Mikrometer langen, ovalen Höhlen sitzen die Osteozyten.“
Schaut man sehr genau hin, erkennt man bereits eine feine Struktur, die von den Blutgefäßen weg nach außen verläuft: ein Labyrinth aus Kanälen. Wenn die Forscher die Knochenprobe nun in eine Lösung mit dem fluoreszierenden Farbstoff Rhodamin eintauchen und dann unter ein konfokales Laserrastermikroskop legen, wird die helle, filigrane Struktur auf schwarzem Grund ganz deutlich, wie feinstes Häkelmuster: das lakuno-kanalikuläre Netzwerk. Auch wenn die Zellkörper der Osteozyten fest in den Lakunen sitzen, sind sie über das Kanalnetzwerk und bis zu 80 fingerartige Zellausstülpungen mit ihren Nachbarzellen verbunden. Es erinnert an das neuronale Netzwerk im Gehirn. „Mit dem Färbemittel gelangen wir in Bereiche, die uns sonst nicht zugänglich wären. Es bedeckt die gesamte innere Oberfläche des Höhlensystems und wird durch den Laser zur Fluoreszenz angeregt“, erklärt Wagermaier. Knochen ist nicht transparent, aber ein wenig lässt sich auch mit einem Lichtmikroskop hineinschauen. Mit konfokaler Mikroskopie, bei der ein gebündelter Laserstrahl die Probe abrastert, lassen sich Bilder von verschiedenen Schichten eines Knochens machen und zu einem 3D-Bild zusammensetzen. Dadurch erhalten die Forschenden Einblicke bis in eine Tiefe von 40 Mikrometern, die ihnen detaillierte Informationen über die Dichte und die Konnektivität des lakuno-kanalikulären Netzwerks liefern. Um dessen Ausmaß zu quantifizieren, zog Mathematiker Weinkamer es virtuell aus dem Knochenmaterial heraus und ließ den Computer rechnen. „Würde man die Kanälchen aus nur einem Kubikzentimeter Knochen aneinanderreihen, würden sie sich zu einer Strecke von etwa 74 Kilometern summieren! Das ist wirklich spektakulär.“

Das Gesetz von Julius Wolff besagt, dass Knochen genau dort verstärkt wird, wo es mechanisch nötig ist. Aber wo befindet sich der Sensor, der diesen Prozess steuert? Dass Zellen mechanisch sensitiv sind, ist bekannt. Doch der Druck, der von außen auf den recht steifen Knochen wirkt und diesen kaum deformiert, ist nicht ausreichend, um Osteoblasten und Osteoklasten zu aktivieren. Die Osteozyten könnten hier eine wichtige Rolle spielen – so die bereits Anfang der 1990er-Jahre formulierte Fluid-Flow-Hypothese. Die Idee: Das gesamte Netzwerk aus Kanälchen und Höhlen der Osteozyten ist mit Flüssigkeit gefüllt. „Es ist im Grunde wie bei einem nassen Schwamm. Drückt man ihn zusammen, geht die Flüssigkeit dorthin, wo sie rauskann. Bei mechanischer Belastung des Knochens wird die Flüssigkeit des Netzwerks in die breiten Kanäle um Blutgefäße gedrückt“, erklärt Weinkamer. Die Osteozyten spüren die Kräfte der Flüssigkeit, wenn diese über ihre Oberfläche spült. Grob gilt: Je stärker der Knochen belastet wird, desto schneller fließt die Flüssigkeit. „Und diese Information geben die Osteozyten über das Netzwerk bis an die Knochenoberfläche weiter. Dort sitzen die Osteoblasten und Osteoklasten und übernehmen dann.“
Knochentraining für Mäuse
Testen ließ sich die Hypothese jetzt, weil die Potsdamer Forschenden das Kanalnetz im Knochen abbilden konnten. Mit seiner Kollegin Bettina Willie von der McGill University im kanadischen Quebec untersuchte Weinkamer dafür drei genetisch identische Mäuse. Die Nager wurden narkotisiert, eines ihrer Hinterbeinchen wie im Fitnessstudio in eine Beinpresse gelegt und ein wenig mechanischer Druck auf die Längsachse ausgeübt. Das untrainierte zweite Bein diente als Kontrolle. Anschließend wurden die Nager für Knochenaufnahmen in den Computertomografen geschoben und wieder aufgeweckt. Das ganze Prozedere durchliefen die Mäuse mehrmals. Die Auswertung aller Daten ergab ein genaues Bild davon, wo nach dem Fitnesstraining neuer Knochen gebildet wurde und wo nicht.
Das Potsdamer Team untersuchte dann detailliert die lakuno-kanalikulären Netze mit mehreren Millionen kleiner Kanälchen in den Knochen der drei Mäuse. Anhand der Netzwerkdaten berechneten die Forschenden anschließend den Flüssigkeitsfluss durch die Netzwerke. Auf diese Weise lässt sich simulieren, wo am Querschnitt des Mäusebeins Knochen zuwachsen müsste und wo mit Schwund zu rechnen war. Und tatsächlich: Die Umbauten traten genau dort auf, wo die Simulation es vorhersagte. Mithilfe des Knochentrainings für die drei kanadischen Mäuse konnten die Forschenden also belegen, dass der mechanische Sensor im Knochen tatsächlich so funktioniert wie von der Fluid-Flow-Hypothese vorhergesagt. Dabei hatten die Knochen der drei Mäuse zwar alle auf das Training reagiert – aber unterschiedlich stark. Warum, das fand Richard Weinkamer heraus, als er anhand von Proben der entscheidenden Knochenbereiche die Kanalnetzwerke haargenau verglich. Berechnungen zur Fließgeschwindigkeit ergaben, dass die Netzwerkarchitektur von Maus zwei, die im Training weniger Knochen zulegte, nur einen langsameren Flüssigkeitsfluss zuließ.
Die Knochenbildung vom Embryo bis hin zum ausgewachsenen Wirbeltier folgt einem ausgeklügelten Programm. Der ständige Umbau ist von Anfang an Teil davon. „Alles beginnt mit einer Knorpelanlage. Sobald ein wenig Knochen da ist, wird von innen etwas ab- und außen angebaut“, erklärt Richard Weinkamer. „So vergrößert sich peu à peu der Radius eines Knochens. Das Längenwachstum ist etwas komplizierter.“ Das Calciumphosphat wird dabei in einem zweistufigen Prozess abgebaut. Zuerst lösen die Osteoklasten mit Säure das Mineral heraus. Dazu entwickeln sie gewissermaßen Finger – winzige Zellausstülpungen, die sie regelrecht in das Material eintauchen. Im zweiten Schritt wird die Kollagenmatrix enzymatisch zerschnitten. Doch wie kommen die Osteoblasten wieder an das Baumaterial? Nach dem Transportweg für das Calciumphosphat suchen Wagermaier und Weinkamer gerade. „Offenbar passiert da eine Art Recycling. Das Mineral wird zum Teil in Vesikeln verpackt. Wir suchen unter dem Elektronenmikroskop nach diesen Vesikeln und führen Berechnungen durch, wie viele durchgeschickt werden müssten, um den Knochen zu mineralisieren“, erklärt Weinkamer. Inzwischen häufen sich die Hinweise auch aus der Forschung des Potsdamer Teams, dass die Osteozyten bei der Regelung des Mineralhaushalts ebenfalls mitmischen. Der Ab- und Einbau des Calciumphosphats, die sogenannte Mineralhomöostase, scheint jedenfalls ein sehr aufwendiger Prozess zu sein. „Das lakuno-kanalikuläre Netzwerk könnte auch dazu dienen, dass das Mineral herausgelöst wird, ohne die Kollagenmatrix komplett zu zerstören“, meint Wolfgang Wagermaier.
Störungen bei der Mineralisierung und Demineralisierung des Knochens sind die Ursache vieler Knochenkrankheiten. Zum Beispiel bei Osteoporose oder der Glasknochenkrankheit Osteogenesis imperfecta. An Mausmodellen, die bestimmte genetische Defekte haben, die menschlichen Knochenkrankheiten ähneln, versuchen Forscherinnen und Forscher weltweit etwas über diese Erkrankungen zu lernen – und mögliche Therapieansätze zu erkennen.

Während Richard Weinkamer sich auf die Lakunen und das Kanalgespinst konzentriert, interessiert sich der Materialwissenschaftler Wolfgang Wagermaier vor allem für die Bereiche, die unter dem konfokalen Laserrastermikroskop schwarz erscheinen: das kompakte Knochenmaterial, das das Kanalnetz umgibt wie der Fels eines Berges ein Höhlensystem. Um es sichtbar zu machen, beschießt Wagermaiers Team am Elektronenspeicherring Bessy II in Berlin-Adlershof Proben mit kurzwelliger Röntgenstrahlung. So entstehen Streubilder, aus denen sich die Größen der Mineralpartikel in der Kollagenmatrix ermitteln lassen. Als Bio-Inspiration für neue Materialien sucht Wagermaier nach Zusammenhängen zwischen den Materialparametern – den Orientierungen der Kollagenfasern oder den Größen der Mineralpartikel etwa – und der Architektur des lakuno-kanalikulären Netzes. In polarisiertem Licht sieht man die ringförmige Struktur der Kollagenmatrix. Schaut man mit Kleinwinkel-Röntgenstrahlung tiefer in die Struktur, so erkennt man die Kollagenfibrillen. Noch mehr Details liefert die Weitwinkel-Röntgenstreuung. „Jede Fibrille enthält viele Kollagenmoleküle, die erstaunlich regelmäßig angeordnet sind“, sagt Wagermaier. „Jedes einzelne Kollagenmolekül ist zu einer etwa 300 Nanometer langen Tripelhelix verdrillt. Zwischen den Kollagenhelices befinden sich Lücken von etwa 40 Nanometern.“ In diesen Lücken beginnen die Mineralplättchen zu wachsen, die – je nach Knochentyp – zwei bis sieben Nanometer dick werden.
Kunststoff mit mineralischen Nanopartikeln
Die Kombination aus weichen Fasern und harten Partikeln optimiert auch synthetische Materialien. So ergab eine Studie mit Hans Börner von der Humboldt-Universität zu Berlin, dass mineralische Nanopartikel, die mit einer Art Klebstoff an den Grenzflächen in eine Polymermatrix eingebunden werden, den Kunststoff deutlich fester und steifer machen. Beim Aufbau der Knochenstruktur, die der Werkstoffwissenschaft als Vorbild dient, leisten die Osteoblasten Feinstarbeit. Die Auswirkungen davon sind aber häufig auch makroskopisch sichtbar. „Tennisspieler, die regelmäßig auf den Platz gehen, haben im Schlagarm mehr Knochenvolumen“, sagt Wagermaier. Und bei Windhunden, die in Rennen immer wieder im Kreis laufen, sind die Knochen der äußeren Beine oftmals etwas dichter als die der inneren. Generell gilt für Knochen: Fehlt der mechanische Reiz, dann schwindet Masse. Ein Problem, das nicht nur durch Bewegungsmangel im Alter auftritt, das vielmehr auch Astronauten während langer Raumflüge zusetzt. Bei Probanden, die für eine Nasa-Studie vier Wochen das Bett nicht verlassen durften, schwand neben der Muskel- auch Knochenmasse. Wie stark, das war individuell verschieden. Weinkamer und Wagermaier vermuten, dass, wie bei den Mäusen, Unterschiede in der Netzwerkstruktur der Knochen eine Rolle spielen.
Knochen können sich lebenslang umbauen und erneuern. Trotzdem geht es ab etwa dem 35. Lebensjahr mit der Knochendichte bergab. „Warum, das wissen wir nicht. Vielleicht wird auch das Mechanosensing-System der Knochen mit zunehmendem Alter unempfindlicher? Genau wie unsere anderen Sinnesorgane – die Augen,
die Ohren – schwächer werden“, sagt Wagermaier. Prophylaktisch mit Medikamenten nachzuhelfen hält er nicht für sinnvoll. Lieber durch Bewegung und leichtes Krafttraining gegensteuern. So lässt sich der Druck auf die Knochen aufrechterhalten, damit ihre Restaurierung bis ins hohe Alter nicht ins Stocken gerät.
Auf den Punkt gebracht
Knochen werden ständig erneuert und umgebaut. Osteozyten und das lakuno-kanalikuläre Netzwerk spielen dabei eine zentrale Rolle.
Studien, an denen Max-Planck-Forschende beteiligt waren, belegen die Fluid-Flow-Hypothese. Demnach nehmen die Osteozyten wahr, wenn sich durch äußeren Druck die Geschwindigkeit ändert, mit der Flüssigkeit durch das lakuno-kanalikuläre Netzwerk fließt. Es mehren sich Hinweise, dass die Osteozyten und das lakuno-kanalikuläre Netzwerk auch am Recycling von Knochenmaterial beteiligt sind.
Erkenntnisse dazu, wie die Erneuerung von Knochen gesteuert wird, könnten das Verständnis von Krankheiten wie Osteoporose verbessern.
Die genaue Kenntnis des Knochenaufbaus inspiriert die Entwicklung besonders fester und steifer Materialien.