Forschungsbericht 2021 - Max-Planck-Institut für Herz- und Lungenforschung
Mögliche Bedeutung des Zellrezeptors P2Y10 für Autoimmun-Erkrankungen
Einleitung
Bei der Immunabwehr handelt es sich um ein komplex reguliertes System, an dem neben verschiedenen Zelltypen auch eine Vielzahl an Botenstoffen und Entzündungsmediatoren beteiligt sind. Oftmals sind die grundlegenden Prozesse noch nicht vollständig geklärt. Deshalb ist es umso verständlicher, dass auch die möglichen Ursachen von Autoimmunerkrankungen, wie Fehlfunktionen oder überschießende Reaktionen des Immunsystems, oft gar nicht oder nur in Teilen erforscht sind.
Ein wesentlicher Bestandteil der körpereigenen Immunabwehr sind die Leukozyten (weiße Blutkörperchen). Von diesen gibt es verschiedene Zelltypen, die wie einzelne Zahnräder in einer Maschine unterschiedliche Aufgaben der Immunabwehr übernehmen. Als wir im Experiment die Expression der sogenannten G-Protein-gekoppelten Rezeptoren auf unterschiedlichen Zellen untersuchten, wurden wir auf einen besonderen Rezeptor aufmerksam: Der Rezeptor P2Y10, den wir auf T-Helferzellen bzw. CD4-T-Zellen fanden, war vor allem auf solchen T-Helferzellen besonders häufig, die im Rahmen einer autoimmunen Entzündung in das Rückenmark eingewandert waren.

T-Zellen werden durch chemische Botenstoffe an den Entzündungsherd gelockt. Diese Wanderung (Migration) wird über verschiedene Rezeptoren gesteuert, viele davon aus der Gruppe der G-Protein-gekoppelten Rezeptoren. Interessant wurde unsere Beobachtung dadurch, dass die Funktionsweise und die Aufgabe von P2Y10 bislang noch nicht ausreichend geklärt ist. Unser Institut ist auf Mausgenetik ausgerichtet, so dass alle Werkzeuge etabliert sind, mit denen in das Genom von Mäusen eingegriffen werden kann. Wir schalteten deshalb zunächst mit Hilfe eines gentechnischen Eingriffs das P2Y10-Gen speziell auf den T-Helferzellen aus, so dass die auf diese Weise manipulierten Zellen keine Rezeptormoleküle dieses Typs mehr auf ihrer Oberfläche besitzen. Anschließend verglichen wir die Eigenschaften der T-Helferzellen mit solchen, die genetisch unverändert waren.
Ohne P2Y10-Rezeptor weniger Leukozyten am Entzündungsherd
Im Rahmen der Immunreaktion erfolgt zunächst eine chemische Stimulierung der „ruhenden“ T-Zellen. Die Zellen durchlaufen dann eine ganze Reihe von Reaktionen. Dazu gehören Aktivierung, Wachstumsreaktion, Differenzierung, Polarisierung und Migration. In unseren Untersuchungen stellte sich heraus, dass T-Helferzellen ohne den P2Y10-Rezeptor eine normale Aktivierung, Zellvermehrung und Differenzierung zeigen. Jedoch war bei den gentechnisch veränderten Zellen ein wesentliches Element, nämlich die Migration, eingeschränkt. Dies bedeutet, dass ohne P2Y10 die Zellen weniger gut zum Entzündungsherd wandern konnten. Ein großer Anteil der Zellen zeigte sogar überhaupt keine Reaktion auf den chemischen Reiz, das heißt, ohne P2Y10 gelangten insgesamt weniger Leukozyten an den Entzündungsherd.
Deswegen untersuchten wir die Rolle des P2Y10 Gens in einem Tiermodell für Multiple Sklerose, einer chronisch-entzündlichen Erkrankung des zentralen Nervensystems. Hier wird eine Entzündung des Nervensystems experimentell ausgelöst und man kann anschließend die Funktionsweise der T-Zellen analysieren. Die Auswertung der Daten ergab, dass bei sogenannten Knockout-Tieren, deren T-Helfer-Zellen den Rezeptor P2Y10 nicht besitzen, deutlich weniger T-Helferzellen in das Rückenmark, dem Ort der Entzündung, einwanderten. Auch insgesamt zeigte sich bei den Knockout-Tieren eine deutlich weniger starke Entzündungsreaktion. Auf diese Weise ergaben sich aus diesem Experiment deutliche Hinweise auf eine Beteiligung von P2Y10 an entzündlichen Autoimmunerkrankungen.
Die P2Y10-vermittelte Immunantwort ist selbstverstärkend
In weiteren Experimenten entschlüsselten wir weitere Details des zugrundeliegenden Mechanismus. Demnach kontrolliert P2Y10 das Migrationsverhalten der T-Helferzellen über eine sogenannte auto-/parakrine Rückkopplungskette, bei der die Migration sowohl von Faktoren im Umfeld der Zellen als auch durch die Zellen selbst beeinflusst wird. Diese Art der Rückkopplung ist immer dann beteiligt, wenn eine schnelle Verstärkung einer Reaktion notwendig ist.
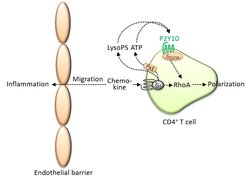
Im Zellinneren von CD4-Zellen spielt ein Molekül, RhoA, dabei die entscheidende Rolle. RhoA beeinflusst die Proteine des Zytoskeletts und ist deshalb für die Ausbildung einer morphologischen Zellpolarität und die Migration von Zellen wichtig. Bislang dachte man, dass die die Zellwanderung auslösenden Botenstoffe, die Chemokine, RhoA direkt aktivieren. Unsere Daten legen hingegen nahe, dass es sich hier um eine auto- und parakrine Aktivierung handelt. An der Regulierung beteiligt sind Adeninnukleotide und Lysophospholipide. Beide Substanzen werden von CD4-Zellen freigesetzt, wenn sie initial durch Chemokine aktiviert werden. In der Folge führt dies dazu, dass sich durch die freigesetzten Nukleotide und Lysophospholipide die Zellmigration selbst verstärkt.
Der Zellrezeptor P2Y10 als Kandidat für zukünftige Therapieansätze
Im Rahmen unserer Forschung möchten wir uns nicht ausschließlich auf die Grundlagenforschung beschränken. Unser Interesse ist auch, die klinische Relevanz unserer Studien zu untersuchen. Deshalb untersuchten wir, ob dieser Mechanismus auch bei Patienten mit neurologischen Autoimmunerkrankungen beteiligt sein könnte. Tatsächlich ließ sich die P2Y10-vermittelte Verstärkung der Migration nicht nur bei Mäusen nachweisen, sondern auch in humanen CD4 T-Zellen, insbesondere auch bei Zellen aus Patienten mit Multipler Sklerose. Auch an Autoimmunerkrankungen außerhalb des zentralen Nervensystems könnte P2Y10 beteiligt sein. So fanden wir in unserer Studie Hinweise darauf, dass P2Y10 das Migrationsverhalten von T-Zellen bei Entzündungen der Haut beeinflusst.
Aus unserer Sicht stellen die Daten eine gute Ausgangsstelle für weitere Untersuchungen dar, mit deren Hilfe therapeutische Ansätze erforscht werden sollen. Die zentrale Frage wird hierbei sein, ob P2Y10 ein Anknüpfpunkt für eine Therapie sein könnte, beispielsweise mit pharmakologisch aktiven Substanzen.