Forschungsbericht 2020 - Max-Planck-Institut für molekulare Biomedizin
Der schlafende Embryo
erforderlich sind.
Der unserer Sonne nächstgelegene Stern – der Rote Zwerg Proxima Centauri mit seinen beiden Planeten Proxima b und c - liegt "nur" 4,2 Lichtjahre von unserer Sonne entfernt, sozusagen in unserem kosmischen Hinterhof. Nichtsdestotrotz würde eine Reise dorthin Jahrtausende brauchen, so dass ein Besuch dieser Planeten noch immer im Reich der Fiktion liegt. Science-Fiction-Romane stellen sich menschliche Missionen zu entfernten Planeten so vor, dass die Reisenden in Stasiskapseln liegen, in denen ihre physiologischen Prozesse verlangsamt sind.
Aus dem Tierreich kennt man den Zustand des so genannten Scheintodes – er ist reversibel und ermöglicht die Reaktivierung der normalen physiologischen Geschwindigkeit der Körperfunktionen [1]. Bei Insekten wurde ein natürlich auftretender Zustand des Scheintodes, auch Diapause genannt, beschrieben. Dabei handelt es sich um einen hormonell gesteuerten Prozess, der eine jahreszeitliche Anpassung an die lokale Umwelt ermöglicht. So erzeugen beispielsweise jahreszeitliche Schwankungen der Temperatur und Lichtverhältnisse eine Stasis in den befruchteten Eiern des Seidenspinners und des Monarchfalters [2]. Doch können auch Säugetiere ihre Entwicklung pausieren? Mitte des 19. Jahrhunderts beobachteten Jäger beim Rehwild eine überraschende Diskrepanz zwischen dem Paarungszeitpunkt und dem Verlauf der Trächtigkeit. Da die Paarung im Sommer stattfindet, sollte im Winter die Trächtigkeit bis in ein spätes Fötalstadium fortgeschritten sein. Stattdessen pausierte die Entwicklung der Rehembryonen für mehrere Monate in einem sehr frühen Stadium kurz vor der Einnistung [3]. Durch diese Anpassung können ungünstige Umweltbedingungen umgangen werden. Mittlerweile wurden mehr als 130 Säugetierarten mit embryonaler Diapause gefunden, so auch die Hausmaus, der bevorzugte Modellorganismus für die biomedizinische Forschung [3]. Obwohl der Prozess der "normalen" (vorübergehenden) murinen Embryogenese intensiv untersucht worden ist, ist die embryonale Diapause immer noch ein außergewöhnlich rätselhafter Zustand, und ihre intrinsischen Regulationsmechanismen sind weitestgehend unbekannt. Hier wollten wir verstehen, ob spezifische Signalkaskaden und molekulare Faktoren ausschließlich während der Diapause aktiviert werden, um das Entwicklungspotential des Embryos aufrechtzuerhalten.
Aktive Zellsignalprozesse und Umformung während der Stasis
Es dauert viereinhalb Tage, bis sich der Maus-Embryo von einer befruchteten Eizelle zur Blastozyste entwickelt hat. Die Blastozyste besteht aus nur drei Zelltypen – dem Epiblast, einem kleinen Haufen pluripotenter Zellen, der später den gesamten Fötus bildet, und zwei unterstützenden Linien, dem Trophektoderm und dem primitiven Endoderm. Der Prozess der Einnistung in die Gebärmutterwand kann erst im Blastozystenstadium eingeleitet werden, innerhalb eines begrenzten Zeitfensters, welches durch die Aktivität des mütterlichen Östrogens bestimmt wird. In unseren Experimenten senkten wir die Östrogenaktivität, was den Beginn der Einnistung verhinderte und so die Diapause auslöste. Als nächstes analysierten wir die Expression einer Reihe von entwicklungsregulierten Genen. Unsere Ergebnisse weisen darauf hin, dass es während der Embryonendormanz zu einer Aktivierung des Wnt-Signalwegs kommt. Bei dem Wnt-Signalweg handelt es sich um einen evolutionär konservierten Signalweg, der die Kommunikation zwischen Zellen über ausgeschüttete Wnt-Liganden ermöglicht. Wir entdeckten, dass der Signalweg während der Diapause nur im Epiblasten aktiviert wird, und dass dieser sich von einem einfachen Zellhaufen in eine schöne rosettenartige Struktur verwandelt [4].
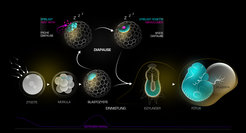
Der Wnt-Signalweg ist im Zuge der normalen Embryonalentwicklung für die Blastozystenbildung unerheblich; er wird erst später für die Etablierung der somatischen Linien während der Gastrulation benötigt [5]. Welche Rolle spielt also der Wnt-Signalweg im dormanten Epiblast? Als wir während der Diapause den Wnt-Signalweg inaktivierten, zerfielen die Epiblastzellen schnell. Außerdem im Epiblast spielt.stellten wir fest, dass die Wnt-Liganden vom Embryo selbst auf autokrine Weise produziert werden. Die Aktivierung des Wnt-Signalweges ist also ein embryoneneigener Prozess, der speziell während der Diapause erforderlich ist, um die Lebensfähigkeit der pluripotenten Linie zu erhalten.
Die Funktion der Rosette und andere offene Fragen
Die Funktion der Rosettenkonfiguration des Epiblasten ist immer noch ein Rätsel. Wir fanden heraus, dass die Bildung dieser Struktur durch Esrrb reguliert wird, einem Transkriptionsfaktor, der unter der direkten Kontrolle der Wnt-Signalkaskade steht. Mittels Elektronenmikroskopie entdeckten wir in der Mitte der Rosette einen kleinen Hohlraum, das als Mikroumgebung für den Austausch von Botenmolekülen für die Zell-Zell- Kommunikation dienen könnte [4]. Ähnlich wie bei Wnt könnte es also zusätzliche, noch unbekannte Signalfaktoren geben, die zelluläre Prozesse während der Diapause regulieren.
Schließlich fanden wir heraus, dass sich das Prinzip der Wnt-Aktivität auch in embryonalen Stammzellen findet. Diese Zellen verfügen über eine uneingeschränkte Differenzierungsfähigkeit und sind vielversprechend im Hinblick auf zukünftige Zellersatztherapien. Die embryonalen Stammzellen "kapern" den Wnt- Signalweg, um ihren undifferenzierten Zustand in vitro aufrechtzuerhalten, ähnlich wie der pluripotente Epiblast des Diapause-Embryos.
Insgesamt ergab unsere Arbeit, dass der Epiblast während der Diapause unter der Kontrolle eines autokrinen Wnt-Signals aufrechterhalten bleibt und aktiv umgestaltet wird. Die fortschreitenden Veränderungen in der Epiblastenarchitektur und der Wnt-Signalantwort zeigen, dass die embryonale Diapause keine vollständige Stasis ist, sondern ein dynamischer Prozess. ihm liegen Mechanismen zugrunde, die für den regulären Ablauf der Embryogenese unerheblich erscheinen. Offen bleibt, ob der Wnt-Signalweg während der Diapause auch bei anderen Säugetierarten genutzt wird und ob sogar menschliche Embryonen in eine Diapause eintreten können.
Literaturhinweise
Trends in Genetics 22(12), 678-689 (2006)
