Forschungsbericht 2019 - Max-Planck-Institut für Stoffwechselforschung
Die Rolle von Neurotransmittern bei der Vermittlung von Hunger und Sättigung
Einleitung
Mit der Aufnahme von Nahrung werden dem Körper lebenswichtige Nährstoffe geliefert. Zu viel oder zu wenig zu essen kann die Gesundheit allerdings gefährden. Daher steuert das Gehirn Hunger und Sättigung mit erstaunlicher Präzision. Dabei nimmt der Hypothalamus, insbesondere ein kleiner Teilbereich darin, der Nucleus Arcuatus (ARC), eine ganz besondere Funktion ein. Im Blut zirkulierende Hormone können die Nervenzellen in diesem Gehirnareal sehr leicht erreichen und diese in ihrer Aktivität steuern. So können die Nervenzellen im ARC den Energiezustand des Körpers auslesen.
Zwei genetisch definierten Nervenzellpopulationen im ARC kommt hierbei eine besondere Rolle zu: Agouti-Related-Peptide (AgRP)-Neurone und Pro-opiomelanocortin (POMC)-Neurone [1]. Während AgRP-Neurone durch Hunger-Hormone aktiviert werden, werden POMC-Neurone durch Sättigungs-Hormone aktiviert. Basierend auf diesen Erkenntnissen ist man bis vor wenigen Jahren von einem Modell ausgegangen, bei dem Hunger und Sättigung wesentlich von AgRP- und POMC-Neuronen in gegensätzlicher Weise vermittelt werden. Durch die Verwendung von Zelltyp-spezifischen neurowissenschaftlichen Methoden konnten in den letzten Jahren jedoch eine Vielzahl von Erkenntnissen gewonnen werden, die dieses einfache Modell in vielen Punkten in Frage stellen. Zum einen konnte gezeigt werden, dass die Aktivierung von AgRP-Neuronen deutlich schneller Hunger auslöst (innerhalb von Minuten) als Sättigung durch die Aktivierung von POMC-Neuronen ausgelöst wird (erst nach Stunden). Daneben fand man heraus, dass AgRP- und POMC-Neurone in ihrer Aktivität nicht nur durch Hormone reguliert werden, sondern auch durch vorgeschaltete Netzwerke. Basierend auf diesen wichtigen Erkenntnissen nehmen wir die Funktionen von ARC-Neuronen und die zugrundeliegenden Schaltkreise im Gehirn genauer unter die Lupe.
Glutamat-freisetzende ARC Neurone sättigen schnell
Der Befund, dass POMC-Neurone keine schnell-wirkenden Neurotransmitter freisetzen, ließ vermuten, dass sie Sättigung nur langsam vermitteln können. Daher untersuchten wir Nervenzellen im ARC, die den schnell-wirkenden Neurotransmitter Glutamat freisetzen [2].
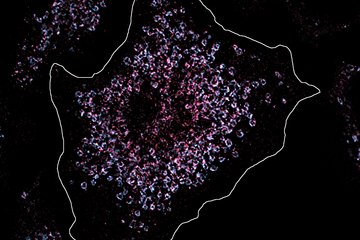
![Abb.1: POMC (grün) und Glutamat-freisetzende Neurone (magenta) liegen direkt nebeneinander im ARC des Hypothalamus [2].](/14232507/original-1591691597.jpg?t=eyJ3aWR0aCI6MjQ2LCJvYmpfaWQiOjE0MjMyNTA3fQ%3D%3D--b6abaa0788cc39809b2fdb2ae81d9eea2357f0f1)
Abb.1: POMC (grün) und Glutamat-freisetzende Neurone (magenta) liegen direkt nebeneinander im ARC des Hypothalamus [2].
Um die Glutamat-freisetzenden Neuronen im ARC zu aktivieren, wurden transgene Rezeptoren speziell in diese Nervenzellen eingebracht. Wurden die Nervenzellen auf diese Weise Zelltyp-spezifisch aktiviert, kam es bei den Mäusen innerhalb kürzester Zeit zu einer verminderten Nahrungsaufnahme [2]. Durch elektrophysiologische Messungen konnten wir nachweisen, dass diese Nervenzellen Glutamat freisetzen und damit zu einer schnellen Aktivierung von nachgeschalteten Nervenzellen und damit zur Sättigung führen.
Mit Sequenzierungsstudien zeigten wir daraufhin, dass Glutamat freisetzende ARC-Neurone Rezeptoren für das Hormon Oxytocin ausprägen [3]. Dies war besonders im Hinblick auf Humanstudien interessant, da die Wirkung des Hormons Oxytocin auf das Essverhalten beim Menschen schon seit einiger Zeit untersucht wird. Analysen mit computerbasierten Modellierungstechniken wiesen darauf hin, dass diese ARC-Neurone mit der Entwicklung von Übergewicht beim Menschen in Zusammenhang stehen.
POMC Neurone bereiten die Leber auf Nahrung vor
POMC-Neurone in Mäusen werden durch das Riechen und Sehen von Nahrung innerhalb von Sekunden aktiviert [4]. Dass diese schnelle Aktivierung schon vor der Nahrungsaufnahme geschieht, deutet darauf hin, dass POMC-Neurone an der sogenannten Kopfphase der Verdauung beteiligt sind. Diese Phase beginnt bereits mit der Wahrnehmung von Nahrung und spielt eine wichtige Rolle bei der Vorbereitung des Körpers auf die später mit der Nahrung aufgenommenen Nährstoffe.

Abb. 2: Das Sehen und Riechen von Nahrung aktiviert POMC Neurone; dies führt zur Aktivierung von Stoffwechselprozessen in der Leber.
Mit einer Reihe von Experimenten konnten wir zeigen, dass diese schnelle Aktivierung von POMC-Neuronen wichtige Signalprozesse in der Leber in Gang setzt [5]. So kann die Leber effizient darauf vorbereitet werden, dass Nährstoffe nach der Nahrungsaufnahme dorthin transportiert werden. Diese Ergebnisse lassen den Schluss zu, dass POMC-Neurone neben der Nahrungsaufnahme auch die Vorbereitung des Körpers auf die verdauten Nährstoffe regulieren.
NPY-Neurone machen schnell hungrig
Dass AgRP-Neurone eine entscheidende Rolle bei der Nahrungsaufnahme spielen, konnte schon in einer Vielzahl von Studien gezeigt werden [1]. Durch die Aktivierung dieser Nervenzellpopulation kommt es zu starkem Hunger. Diese Effekte treten sehr schnell auf, da die Mäuse schon wenige Minuten nach der Aktivierung von AgRP-Neuronen damit beginnen, Futter aufzunehmen. Da das für AgRP-Neurone charakteristische Neuropeptid AgRP langsam wirkt, vermuteten wir, dass ein anderer Botenstoff diese schnellen Prozesse vermittelt.
Bei der Suche fokussierten wir uns auf das Neuropeptid Y (NPY). NPY ist in allen AgRP-Neuronen vorhanden und kann die Aktivität von Nervenzellen innerhalb von Sekunden hemmen, wie elektrophysiologische Experimente gezeigt haben. Um zu überprüfen, ob NPY von AgRP-Neuronen freigesetzt wird und so die Mäuse schnell hungrig macht, verwendeten wir Tiere, die kein NPY besitzen. In diesen Mäusen brachten wir lichtsensitive Ionenkanäle in AgRP Neurone ein, um diese mittels Lichtleitern Zelltyp-spezifisch zu stimulieren. Tatsächlich bewirkte diese AgRP-Stimulierung in Tieren, die kein NPY haben, keine schnelle Veränderung im Hunger. Interessanterweise konnten wir auch herausfinden, dass NPY bei der Hungerregulation nach einer Fastenperiode eine große Rolle spielt. In Tieren die kein NPY besitzen, war die Nahrungsaufnahme in der ersten Stunde nach dem Fasten deutlich geringer.
Ausblick
Die vertiefende Erforschung von ARC-Neuronen erweitert unser Wissen über die Rolle dieses Gehirnareals bei der Regulation der Nahrungsaufnahme. Allerdings werfen unsere Befunde auch eine Vielzahl wichtiger Fragen auf. Welche Gehirnareale sind für die Wahrnehmung von Nahrung verantwortlich? Welche Neurotransmitter vermitteln den Informationsfluss zum ARC? Könnte es bei Fehlfunktionen der Synapsen in diesen Netzwerken zu Störungen des Essverhalten kommen? Um diese Fragen experimentell beantworten zu können, entwickeln wir neuartige genetische Mausmodelle. Diese Modelle ermöglichen es uns, unsere Kenntnis zur Rolle der neuronalen Netzwerke zu vertiefen und so die Entwicklung von Über- oder Untergewicht besser zu verstehen.
Literaturhinweise
Nature Neuroscience 20(1):42-51 (2017)
Nature Neuroscience 20(3):484-496 (2017)
![Abb.1: POMC (grün) und Glutamat-freisetzende Neurone (magenta) liegen direkt nebeneinander im ARC des Hypothalamus [2]. Abb.1: POMC (grün) und Glutamat-freisetzende Neurone (magenta) liegen direkt nebeneinander im ARC des Hypothalamus [2].](/14232507/original-1591691597.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTQyMzI1MDd9--4a918053bcb9fdeef740f2ff9b966d6262aca090)