Forschungsbericht 2019 - Max-Planck-Institut für molekulare Physiologie
Elektroporation im neuen Gewand – Vom Teströhrchen zur lebenden Zelle
Einleitung
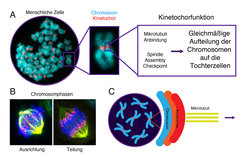
Die Zellteilung ist ein grundlegender Vorgang in lebenden Organismen, bei dem Zellen ihre DNA zunächst verdoppeln und anschließend ihre Chromosomen gleichmäßig auf beide Tochterzellen verteilen. Dieser Prozess wird Mitose genannt. Fehler in den festen räumlichen und zeitlichen Abläufen dieses Vorgangs können zu schweren Krankheiten wie Krebs führen. Der korrekte Ablauf der Zellteilung basiert auf dem dynamischen Zusammenspiel zwischen dem mitotischen Spindelapparat und den Chromosomen angelagerten Proteinkomplexen. Ein solcher Proteinkomplex ist das Kinetochor; es wirkt als Bindeglied zwischen den Chromosomen und dem mitotischen Spindelapparat. Der Spindelapparat besteht aus einem Netzwerk langgezogener röhrenförmiger Proteinpolymere (Mikrotubuli), die für die zielgerichtete Bewegung der Chromosomen während der Mitose zuständig sind. Zur korrekten Ausführung der Mitose dient ein im Kinetochor vorhandener molekularer Überwachungsmechanismus: der Spindle Assembly Checkpoint (Abb. 1; [1]). Unsere Gruppe verfolgt einen interdisziplinären Ansatz, um die molekulare Struktur sowie die Funktionen des Kinetochors im Rahmen der Zellteilung zu erforschen.
Vom Teströhrchen zur lebenden Zelle
Um die Komplexität des Kinetochors zu vereinfachen, verwenden wir einen reduktionistischen Ansatz, indem wir die individuellen, aufgereinigten Bestandteile des Kinetochors in einem Teströhrchen, d.h. in vitro, zusammenbringen und so ihre strukturellen, biophysikalischen und biochemischen Eigenschaften untersuchen. Diese in vitro-Rekonstitution des “synthetischen” Kinetochors hilft uns, Vorhersagen über das Verhalten der Bestandteile in der lebenden Zelle zu machen [2]. Im nächsten Schritt müssen unsere Schlussfolgerungen in der lebenden Zelle überprüft werden. Der Übergang von in vitro-Experimenten zu Untersuchungen in der Zelle bringt jedoch eine Schwierigkeit mit sich: Die aufgereinigten Proteine müssen in die lebende Zelle eingebracht werden, was durch die Zellmembran, die als effiziente Barriere gegen große Proteinmoleküle fungiert, verhindert wird. Zusammen mit unserem Forschungspartner Phil Selenko vom FMP Berlin haben wir deshalb eine Methode auf Grundlage der Elektroporation entwickelt, die es uns erlaubt, aufgereinigte Proteine zielgerichtet in die Zelle zu transportieren.
Eine alte Methode im neuen Gewand
Die Elektroporation (EP) ist eine Methode, die kurze elektrische Pulse verwendet, um reversible Durchlässe (Poren) in der Zellmembran lebender Zellen zu erzeugen. Diese Methode wird seit über 40 Jahren verwendet, um kleine biologische Moleküle wie DNA und RNA in die Zelle zu schleusen. Mit unserer neuen EP-Methode bringen wir hingegen aufgereinigte Proteine, d.h. größere biologische Moleküle, in menschliche Zellen ein. Eine Besonderheit dabei ist, dass die eingeschleusten Proteine in der Zelle ihre korrekten physiologischen Funktionen bewahren und so mithilfe einer Bandbreite zellbiologischer Anwendungen erforscht werden können [3].
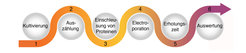
Abb. 2: Schematische Darstellung des Arbeitsflusses bei der Elektroporation.
Nach erfolgter Elektroporation und einer kurzen Erholungsphase werden die Zellen mit verschiedenen Versuchsmethoden beobachtet und analysiert (Abb. 2). Zum Beispiel können wir innerhalb der Zellen die Lokalisation von Proteinen, die wir mit einem Fluoreszenzfarbstoff markiert haben, live am Fluoreszenzmikroskop untersuchen.
Die Untersuchung des Kinetochors mittels Elektroporation
Die Verwendung der Elektroporation für die Erforschung des Kinetochors in lebenden Zellen bringt einige Vorteile mit sich, denn erstens ist das Kinetochor eine leicht erkennbare Struktur, für die wir verschiedene zelluläre Lokalisationsmarker haben; zweitens besitzen wir eine große Sammlung von Proteinen, deren biochemische und strukturelle Eigenschaften wir bereits in vitro charakterisiert haben; und schließlich haben wir bereits verschiedene bewährte funktionelle Tests (Assays) etabliert, die wir benutzen können, um die Funktionalität der elektroporierten Proteine zu überprüfen.
Wir haben diese Vorteile genutzt, um Proteinkomplexe des Kinetochors in die Zelle zu schleusen und ihre Funktionen zu erforschen. Zu diesen Komplexen gehört auch das Constitutive Centromere Associated Network (CCAN), ein 16-Komponenten-Proteinkomplex, der eine stabile mechanische Schnittstelle bildet zwischen den Chromosomen und den äußeren Kinetochorbestandteilen, die für die Mikrotubuli-Anbindung verantwortlich sind. Durch die in vitro-Rekonstitution haben wir die überraschende Entdeckung gemacht, dass einer der Unterkomplexe des CCAN, nämlich der aus fünf Untereinheiten bestehende CENP-OPQUR-Komplex, eine bedeutende Funktion bei der Bindung an die Mikrotubuli ausübt. Wir konnten auch einen Bereich von CENP-Q identifizieren, der speziell für diese Bindung notwendig ist [4]. Mittels Elektroporation haben wir mit Fluoreszenz-Labeln markierte und aufgereinigte CENP-OPQUR-Komplexe zum einen in ursprünglicher Form, zum anderen in mutierter Form, d.h. ohne den für die Bindung notwendigen CENP-Q-Bereich, in lebende Zellen eingebracht. Anschließend nutzten wir die Fluoreszenz-Mikroskopie, um die Anordnung der Chromosomen im Zentrum der mitotischen Zellen zu begutachten. Zu unserem Erstaunen stellten wir fest, dass die elektroporierten Zellen mit der in unserem in vitro-Experiment identifizierten CENP-OPQUR-Mutation ihre Chromosomen nicht korrekt anordnen konnten. Dies spiegelte die Unfähigkeit dieser Chromosomen wider, richtig an die Mikrotubuli zu binden und bestätigte somit die Funktion, die wir zuvor in vitro für CENP-Q entdeckt hatten.
Ausblick
Elektroporation ist ein vielseitiges Werkzeug, um zelluläre Funktionen von Proteinen zu untersuchen. Zusammen mit den jüngsten Entwicklungen in der Proteinmanipulation und der chemischen Biologie stellt unser Ansatz ein flexibles Instrument für eine Bandbreite von Anwendungen dar und ermöglicht neue Erkenntnisse im Bereich der Mitose und anderen Vorgängen in der menschlichen Zelle.
Literaturhinweise
Biology 6 (2017)
EMBO Reports 5 (11),1016-20 (2004)
eLife 8. e48287 (2019)
Molecular Cell 71(6), 923-939.e10. (2018)