Forschungsbericht 2018 - Max-Planck-Institut für Biochemie
Mechanobiologie: Mechanische Signale wahrnehmen dank intrazellulärer Kraftmikroskopie
Kalibrierte Kraftsensoren zur Messung kleinster molekularer Kräfte
Unsere Zellen haben die Fähigkeit, auf komplexe mechanische Signale mit einer biochemischen Antwort zu reagieren. Diese als Mechanosensitivität bekannte Eigenschaft ist seit langem bekannt, doch ist unklar, wie mechanische Kräfte in Zellen verarbeitet werden. Ein wesentlicher Grund dafür ist, dass Kräfte auf molekularer Ebene sehr klein und daher schwer zu messen sind [1]. Üblicherweise liegen die physiologisch relevanten Kräfte im Piconewton-Bereich, also dem billionsten Teil eines Newtons. Um die molekularen Prozesse der als Mechanobiologie bezeichneten Vorgänge besser analysieren zu können, haben wir daher eine Technik entwickelt, mit der die Messung solcher Kräfte in lebenden Zellen möglich wird [2-4].
Das Prinzip dieser Technik ähnelt dem einer Federwaage, durch die mithilfe einer kalibrierten Feder Gewichtskräfte bestimmt werden können. Unser molekularer Kraftsensor folgt einem ähnlichen Prinzip und besteht aus zwei fluoreszierenden Proteinen, die mit einer molekularen Feder verbunden sind. Die Farbstoffe sind so gewählt, dass sie bei geeigneter Anregung einen Energietransfer (genannt FRET) durchlaufen, der wiederum vom Fluorophor-Abstand abhängig ist. Wirken mechanische Kräfte von nur wenigen Piconewton (pN) auf den Kraftsensor ein, verlängert sich die molekulare Feder, der Abstand der Farbstoffe vergrößert sich und es kommt zu einer Verminderung des FRET Effektes. Dieser kann mikroskopisch ausgelesen werden (Abb. 1).
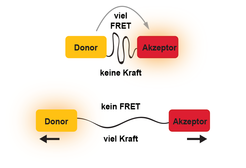
Abb. 1: Arbeitsprinzip eines molekularen Kraftsensors. Die Technik verwendet zwei Farbstoffe, einen FRET-Donor und einen FRET-Akzeptor. Diese Fluorophore sind durch ein dehnbares Peptid verbunden, das als molekulare Feder fungiert. Liegt Kraft an der „molekularen Federwaage“ an, dehnt sich das Peptid aus und vermindert dadurch die FRET Effizienz. Dieser Prozess kann mikroskopisch ausgelesen werden.
Durch die Wahl unterschiedlicher molekularer Federn und Kalibrationen mittels Einzelmolekül-Kraftspektroskopie konnten wir eine Reihe von Kraftsensoren entwickeln, die auf mechanische Kräfte von 1-12 pN reagieren. Da alle Komponenten der Kraftsensoren genetisch kodiert sind, kann die „molekulare Federwaage“ transgen in verschiedenste Zellen eingebracht werden, um dort mechanobiologische Prozesse, insbesondere entlang bestimmter Strukturen, zu messen.
Das Adhäsionsmolekül Talin vermittelt Zellen die Fähigkeit, Gewebesteifigkeiten zu erkennen
Unsere ersten Anwendungen gelangen auf dem Gebiet der Zelladhäsionsmechanik [2, 3]. Zellen haben die Fähigkeit, sich in Geweben zu verankern und an die dort vorliegende Gewebesteifigkeit zu adaptieren. Dieser Vorgang ist für viele zellbiologische Prozesse wichtig und vermutlich auch in Tumoren von Bedeutung, die in aller Regel steifer als das umgebende Gewebe sind. Wie diese Form der Steifigkeitserkennung auf molekularer Ebene vermittelt wird, war bislang weitestgehend unverstanden.
Durch Anwendung der Kraftsensortechnik konnten wir nachweisen, dass ein bestimmtes Protein, genannt Talin, für die mechanische Kopplung des extrazellulären Gewebes mit dem Zellinneren wichtig ist. Unsere Experimente zeigten, dass Talin-Moleküle mechanische Lasten von etwa 7 bis 10 pN während der Zelladhäsion tragen (Abb. 2). Interessanterweise kommt es zu einem nahezu vollständigen Verlust der Steifigkeitserkennung von Zellen, sobald die Talin-Bindung unterbrochen wird [3]. Es wird daher wichtig sein, die Mechanik des Talin-Proteins auch in anderen Zelltypen wie beispielsweise in Tumorzellen zu untersuchen.

Abb. 2: Molekulare Kraftmessung in Zelladhäsionen. Der molekulare Kraftsensor kann genetisch verschlüsselt und in ausgewählte intrazelluläre Proteine eingebracht werden. Um die molekularen Mechanismen der Zelladhäsion zu untersuchen, wurde der Kraftsensor in Talin inseriert. Talin ist ein Protein, das das Zytoskelett mit extrazellulären Proteinen verbindet. FRET Messungen in adhärenten Säugerzellen zeigten, dass Talin mechanischen Kräften von mehr als 7 Piconewton (pN) ausgesetzt ist und eine wichtige Rolle für die Steifigkeitserkennung von Zellen spielt.
Die simultane Messung zweier Kraftsensoren gibt Aufschluss über die Komplexität intramolekularer Kraftweiterleitung
Wie mechanische Kräfte in Zellen entlang einzelner Moleküle weitergeleitet werden, ist eine Frage, die Biophysiker und Zellbiologen gleichermaßen fasziniert. Unsere makroskopisch-materielle Weltsicht verleitet uns zu der Annahme, dass auch Strukturproteine die auf sie wirkenden Kräfte gleichmäßig weiterleiten. Während diese Vermutung für einfache Proteine vielleicht zutreffen mag, besteht aber der Verdacht, dass in anderen Molekülen eine sehr viel komplexere Form der Kraftübertragung vorliegt. Um dieser Frage nachzugehen, haben wir unsere Kraftsensortechnik erweitert, sodass mehrere Kraftsensoren gleichzeitig und innerhalb ein und derselben Zelle vermessen werden konnten [4]. Diese Experimente zeigten, dass große Proteine wie Talin tatsächlich Kraftgradienten aufweisen, die je nach physiologischer Bedingung unterschiedlich stark ausgebildet sind. Zudem demonstrierten unsere Versuche, dass Zellen nicht nur die Kraft entlang einzelner Moleküle, sondern auch den prozentualen Anteil der einer Kraft ausgesetzten Proteine regulieren können. Die Regulation der intrazellulären Kraftübertragung ist scheinbar wesentlich komplizierter als gemeinhin angenommen.
Molekulare Kraftmessung in Desmosomen erklärt die mechanischen Eigenschaften der Haut
Unsere Haut ist der Schutzschild gegen äußere Einflüsse, insbesondere gegen mechanischen Stress. Damit diese Funktion erfüllt werden kann, bilden Hautzellen spezielle Haltepunkte, sogenannte Desmosomen, aus, die die Adhäsion zwischen Zellen verstärken. Menschen mit fehlerhaften Desmosomen leiden unter massiven Hautstörungen, die gerade nach mechanischer Beanspruchung zu Tage treten. Allerdings war bisher kaum verstanden, wie mechanische Kräfte auf die einzelnen Bestandteile der Desmosomen einwirken. Wir haben daher unsere Kraftsensor-Technik angepasst, um die molekularen Kräfte in genau diesen Strukturen zu untersuchen [5]. Als Ergebnis stellte sich heraus, dass Desmosomen gar keinen mechanischen Belastungen ausgesetzt sind, solange auch keine äußeren Kräfte auf die Zellen einwirken. Wird jedoch an den Zellen gezogen, werden mechanische Belastungen sichtbar, die von der Stärke des Stresses und dessen Ausrichtung abhängen. Desmosomen scheinen also Strukturen zu sein, die immer dann unverzichtbar werden, wenn die Haut hohen mechanischen Belastungen ausgesetzt ist.
Ausblick
Die Kraftsensor-Technik wird mittlerweile in einer Vielzahl von Laboren angewendet und ist nicht nur in Zellen, sondern in auch in Modellorganismen wie Drosophila-Fliegen und Zebrafischen zum Einsatz gekommen. Dabei wurden neue zelluläre Mechanismen identifiziert und analysiert, die uns vor wenigen Jahren noch verschlossen waren. Durch kontinuierliche Weiterentwicklung der Methode werden wir weiteren Geheimnissen der zellulären Mechanobiologie auf die Spur kommen.
Literaturhinweise
Nature Cell Biology 17, 1597-1606 (2015)

