Forschungsbericht 2010 - Max-Planck-Institut für Immunbiologie und Epigenetik
Die Stabilität von Bob1 in B-Zellen
Max-Planck-Institut für Immunbiologie und Epigenetik, Freiburg
B-Zell-Entwicklung
Ein wichtiger Teil der Immunantwort besteht in der Fähigkeit, antigenspezifische Immunglobuline (Antikörper) zu produzieren. Die Quelle dieser Immunglobuline sind B-Zellen, die im Laufe des Lebens kontinuierlich aus hämatopoietischen Stammzellen in der fötalen Leber oder im adulten Knochenmark generiert werden. Es konnten verschiedene Stufen der B-Zell-Entwicklung identifiziert werden, unter anderem die Vorläufer-B-Zellen (pro- und prä-B-Zellen), reife B-Zellen (naive und ruhende B-Zellen), aktivierte Keimzentrums-B-Zellen, Gedächtnis-B-Zellen und Antikörper-produzierende Plasmazellen. Während neu produzierte (naive) B-Zellen eine relativ kurze Lebensdauer von einigen Tagen haben, besitzen Gedächtnis-B-Zellen eine Halbwertszeit von mehreren Monaten (Abb. 1).

Bob1- wichtig für die Entwicklung und Funktion von B-Zellen
Die Reifung von B-Zellen ist mit einer komplexen, aber geordneten Regulation der Genexpression verbunden. Hierbei spielen Transkriptionsfaktoren eine wichtige Rolle. Es sind mehrere Beispiele bekannt, bei denen eine Mutation oder das Fehlen von Transkriptionsfaktoren zu einer fehlerhaften B-Zell-Entwicklung führen. Die Untersuchung des Immunsystems in solchen Mutanten liefert oft wichtige Hinweise auf die Funktion des betroffenen Transkriptionsfaktors.
Bob1 ist ein lymphozytärer Transkriptionsfaktor mit einer Masse von 34 kD. Bob1 bindet zusammen mit einem zweiten Transkriptionsfaktor (entweder Oct-1 oder Oct-2) an eine acht Nukleotide lange DNA-Sequenz (ATGCAAAT) und stimuliert die Transkription (Abb. 2).
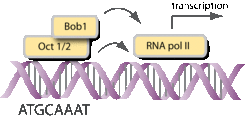
Oft haben Gene, die für das Immunsystem wichtig sind, diese Oktamer-Sequenz im Promotor- oder Enhancer-Bereich (z. B. Gene für die leichten und schweren Ketten der Immunglobuline). Es konnte gezeigt werden, dass ein minimaler Promotor, bestehend aus einer TATA-Box und der Oktamer-Sequenz, ausreichend für eine lymphozytenspezifische Transkription ist. Mäuse mit einem defekten Bob1-Gen zeigen Störungen in der B-Zell-Entwicklung und -Funktion und sind immundefizient [1-3]. Ebenso wurden Veränderungen in der T-Zell-Funktion beobachtet [4]. Da Bob1 nur in B- und T-Zellen exprimiert ist, ist es verständlich, dass Defekte in anderen Geweben nicht auftreten. In Bob1-defekten Mäusen werden 2- bis 3-mal weniger B-Zellen produziert und die Aktivierbarkeit der B-Zellen ohne Bob1, zum Beispiel über deren B-Zell-Rezeptor, ist deutlich geringer. Eine Folge dieser B-Zell-Defekte ist eine stark reduzierte Antikörperproduktion nach Immunisierungen. Keimzentrums-B-Zellen fehlen völlig. In Menschen sind bisher keine funktionellen Mutationen von Bob1 beschrieben worden. Mehrere Versuche, Bob1-Mutationen in immundefizienten Patienten zu finden, blieben bis jetzt erfolglos.
Die Stabilität von Bob1
Es gibt Hinweise, dass die Menge von Bob1 einen wichtigen Einfluss auf die B-Zell-Entwicklung und -Funktion hat. Die Expression von Bob1 wird bereits in pro-B-Zellen beobachtet und bleibt während der ganzen B-Zell-Entwicklung erhalten. Während die Expression in pro-B- und reifen B-Zellen relativ niedrig ist, haben prä-B- und aktivierte Keimzentrums-B-Zellen deutlich höhere Mengen an Bob1. Wie oben erwähnt, scheint das Fehlen von Bob1 in der Maus die B-Zell-Entwicklung besonders in den prä-B- und Keimzentrums-B-Zellstadien zu inhibieren. Andererseits kann aber auch eine erhöhte und verfrühte Bob1-Expression die B-Zell-Entwicklung in der Maus stören [5]. Abnormale, erhöhte Bob1-Expression könnte auch an der Entstehung von bestimmten menschlichen B-Zell-Lymphomen beteiligt sein [6; 7]. Alle diese Beobachtungen sprechen dafür, dass B-Zellen die Menge an Bob1 genauestens regulieren müssen.
Wie aber wird die Menge des Bob1-Proteins reguliert? Obwohl Unterschiede in den Mengen an Bob1-mRNA in verschiedenen B-Zellarten vorkommen können, scheint der Hauptregulationsmechanismus der Bob1-Proteinmengen eher bei Änderungen der Proteinstabilität zu finden zu sein. Zum Beispiel haben aktivierte B-Zellen wesentlich mehr Bob1-Protein als ruhende B-Zellen, obwohl die mRNA-Menge nicht erhöht ist. Bob1 ist in der Regel ein kurzlebiges Protein und die Inhibition eines wichtigen Protein-Abbau-Systems der Zelle, des Ubiquitin/Proteasom-Systems, führt zur Stabilisierung von Bob1 [8; 9]. Es wurde auch beobachtet, dass die In-vitro-Stimulation von reifen B-Zellen über ihren B-Zell-Rezeptor ohne co-stimulatorische Signale zu einem Abbau von Bob1 (und zu einer Reduktion der Immunglobulin-Genexpression) führt. Vermutlich müssen zusätzliche, bis jetzt nicht identifizierte Signale dieser Destabilisierung entgegenwirken, wenn B-Zellen über ihren B-Zell-Rezeptor von Antigenen aktiviert werden.

Wie intrazelluläre Signalwege die Stabilität von Bob1 regulieren, bleibt weitgehend offen. Es wurde gezeigt, dass RING-Finger-enthaltende Komponenten des Ubiquitin-vermittelten Abbauweges Bob1 binden und destabilisieren können [8; 9]. Ob und wie deren Interaktion mit Bob1 reguliert wird, muss noch gezeigt werden. In der Arbeitsgruppe von Peter Nielsen wurde ein Reporterplasmid entwickelt, mit dem die Regulation der Bob1-Stabilität untersucht werden kann. Dieses Plasmid produziert ein bi-cistronisches mRNA-Transkript, von dem ein grün fluoreszierendes GFP-Bob1-Fusionsprotein und ein rot fluoreszierendes Referenzprotein („Tomato“) translatiert werden kann. Die Bestimmung der Fluoreszenzsignale in einzelnen Zellen ist mittels Durchflusszytometrie einfach, schnell und quantitativ durchzuführen. Veränderungen im Verhältnis zwischen GFP- und Tomato-Fluoreszenz für verschiedene GFP-Fusionsproteine geben einen Hinweis auf unterschiedliche Stabilitäten. Die Stabilität von GFP wird erheblich reduziert, wenn es mit Bob1 fusioniert wird, wobei das Fusionsprotein jedoch ebenso stabil ist wie das unfusionierte Bob1, wenn das Proteasom gehemmt wird (Abb. 3).
Ausblick
Unter anderem sollte es mit dem beschriebenen Reporterplasmid möglich sein, die Stabilität von Bob1 in verschiedenen Entwicklungsstadien oder nach Stimulation des B-Zell-Rezeptors zu messen. Auch können so die Bereiche in Bob1 selbst sowie mögliche weitere intrazelluläre Komponenten identifiziert werden, die für die Stabilitätsregulation wichtig sind. Um die B-Zell-Entwicklung und -Aktivierung besser zu verstehen, wird es nicht nur interessant sein zu wissen, wie die Bob1-Stabilität reguliert wird. Eine wichtige Frage ist auch, ob diese Regulation ein allgemeiner Mechanismus ist, der Proteinstabilität generell während der B-Zell-Entwicklung reguliert oder ob gezielt nur wenige Schlüsselproteine über ihre Stabilität reguliert werden.


