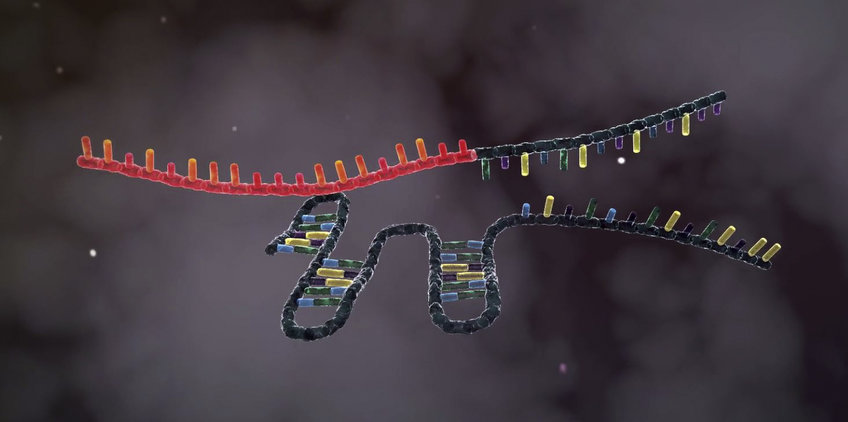
Arbeitsweise von CRISPR-Cas9
Zunächst werden bei CRISPR-Cas9 die CRISPR- und „spacer“-Sequenzen in die CRISPR-RNA (crRNA) übersetzt. Bevor diese dann dem Cas9-Protein den Schnittpunkt auf der DNA zeigen kann, muss sie selbst durch Schneideproteine in ihre endgültige Form gebracht und Teile davon entfernt werden. Ein solches Enzym ist die RNase III. Zusammen mit der tracrRNA wandelt es die Ursprungsform der crRNA in ein ausgereiftes und funktionsfähiges Molekül um.

Die fertige crRNA enthält eine Abschrift der CRISPR-Sequenz und der Fremd-DNA. Damit liefert sie Cas9 die Erkennungssequenz, an der das Schneidemolekül die DNA durchtrennen soll. Die crRNA verbindet sich dabei mit der tracrRNA, denn nur die beiden zusammen können Cas9 den Schnittpunkt zeigen.
Die zur crRNA passende Erkennungssequenz alleine reicht aber nicht, damit Cas9 an DNA binden kann: Es benötigt noch ein sogenanntes „proto-spacer adjacent motif“, abgekürzt PAM. Nur wenn ein solcher drei Buchstaben-langer Abschnitt –zwei Guanin- und eine beliebige Base – neben der Erkennungssequenz liegt, kann Cas9 an den DNA-Faden binden.
Nun entspiralisieren sich die beiden DNA-Stränge, und das crRNA/tracrRNA-Molekül – oder eine künstliche „guide-RNA“ – kann sich anlagern. Das Enzym durchtrennt dann beide Stränge an derselben Stelle. Cas9 braucht also sowohl die Erkennungssequenz als auch ein PAM, damit es DNA schneiden kann. Da das Erbgut des Bakteriums selbst keine PAMs besitzt, ist es vor der Zerstörung durch das eigene Abwehrsystem geschützt.
