Forschungsbericht 2016 - Max-Planck-Institute für experimentelle Medizin
Die Rolle des Kaliumkanals Kv10.1 in Tumoren
The role of Kv10.1 potassium channel in cancer
Einleitung
Die Zellmembran einer einzelnen Zelle trennt den Innenraum der Zelle von der Außenwelt ab, damit im Inneren alle wichtigen Zellprozesse geschützt ablaufen können. Jedoch benötigen alle Zellen Verbindungen zur Außenwelt, um z. B. Signale zum Zellwachstum und zur Zellteilung zu erhalten. Viele dieser Signale werden durch kleine Moleküle oder Proteine vermittelt, die als Botenstoffe an entsprechende Rezeptoren an der Zellmembran andocken. Das Andocken eines Botenstoffes an seinen Rezeptor bewirkt im Inneren der Zelle die Aktivierung von spezifischen biochemischen Signalkaskaden, die im Fall eines Zellteilungssignals zur Zellteilung führen. In Tumoren ist dieser Signalmechanismus gestört; sehr oft, weil ein Rezeptor aktiv ist, obwohl kein Zellteilungsbotenstoff angedockt ist. Die betroffene Zelle vermehrt sich ungehemmt und es entsteht ein Tumor. Während der Evolution haben sich jedoch Mechanismen entwickelt, um derartige Fehlregulationen entdecken und verhindern zu können. Diese können aber ebenfalls defekt sein und zur Tumorbildung führen. Die gängigsten Medikamente, die aktuell zur Krebsbehandlung eingesetzt werden, wirken durch eine generelle Hemmung der Zellteilung. Als Nebenwirkung werden Gewebe mit schneller Zellteilung davon ebenfalls gehemmt. Deshalb fallen z.B. bei der Chemotherapie meist die Haare aus und Patienten können schwere Magen- und Darm-Beschwerden haben, da sich sowohl die Haarfollikelzellen wie auch die Zellen in der Darmwand kontinuierlich teilen müssen.
Poren in den Zellmembranen sind ein anderer Weg, Signale zwischen Außenwelt und Zellinnerem zu vermitteln. Hierbei lassen Proteinkomplexe, die ihre Struktur ändern und sich öffnen können, gezielt geladene Teilchen durch die Membran fließen. Durch ein externes Signal werden von einer Pore jedoch nur eine Art von Ionen (z.B. Kalium, Natrium oder Chlor) durchgelassen. Diese Signale können chemischer oder physikalischer Natur sein. Zu den letzteren gehören auch die spannungsgesteuerten Ionenkanäle, die für die Entstehung und Fortleitung der elektrischen Impulse im Gehirn und entlang erregbarer Zellen, wie peripherer Nerven- oder Muskelzellen, verantwortlich sind. Hier wird auf einen besonderen Ionenkanal eingegangen, der kaliumselektiv und spannungsgesteuert ist und die Bezeichnung Kv10.1 trägt. Er ist einer von über 100 verschiedenen Kaliumkanälen, die in unserem Erbgut kodiert sind.
Die Regelung der Zellteilung
Der Prozess der Zellteilung ist eine streng kontrollierte Reihe von Ereignissen, die zur Erzeugung von zwei Tochterzellen aus einer einzigen Mutterzelle führt. Wenn eine Zelle sich zu teilen beginnt, gibt es zwei Zeiträume, in denen es relativ einfach ist, zu definieren, welche Veränderungen stattfinden: Einerseits die Phase, in der das genetische Material verdoppelt wird und die Zelle aktiv DNA synthetisiert, die so genannte S-Phase oder Synthese-Phase; andererseits dann, wenn die Chromosomen kondensieren, sich trennen und zwischen den beiden Tochterzellen verteilt werden. Diese Phase nennt man Mitose oder M-Phase. Die Zeiten zwischen diesen Phasen sind weniger definiert und werden deshalb gaps (Lücken) genannt, G1 vor der S-Phase und die G2/M-Phase nach der S-Phase. Sobald der Prozess der Zellteilung abgeschlossen ist, fallen die meisten Zellen in einen Ruhezustand (G0), in dem die Zellen ihre Funktionen als reife Zellen erfüllen und sich nicht mehr teilen. In einem entwickelten Organismus befindet sich eine überwiegende Mehrheit der Zellen in der G0-Phase und bleibt für die ganze Lebenszeit darin.
Kv10.1- ein Ionenkanal mit besonderer Funktion
In den G0-, G1- und S-Phasen findet keine oder eine nur sehr geringe Expression von Kv10.1 statt, während Zellen in der G2/M-Phase Kv10.1 exprimieren [1]. Das heißt, eine deutliche Expression von Kv10.1 stammt von vielen Zellen, die sich alle in der G2/M-Phase befinden. Das ist normalerweise von Tumorzellen zu erwarten, weil sie sich sehr aktiv teilen. Im Gegensatz dazu befinden sich in normalen Geweben nur sehr wenige Zellen in der G2/M-Phase des Zyklus. Es gibt jedoch einige außergewöhnliche Gewebe, in denen die Anzahl der Zellen in der G2/M-Phase größer ist. In den Krypten des Dickdarms vermehren sich kontinuierlich nur die Zellen, die tief in den Krypten sitzen; die Zellen nahe der Oberfläche teilen sich nicht mehr. In solchen Geweben sind die Zellen in der G2/M-Phase Kv10.1-positiv, während die restlichen Zellen keine Kv10.1-Expression aufweisen.
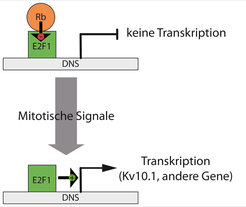
Die Ursache dieser zeitlich beschränkten Expression ist die Steuerung der Kv10.1-Expression durch den Transkriptionsfaktor E2F1 (Abb. 1). E2F1 ist auch der wichtigste Faktor für die Koordination des Zellzyklus in sich teilenden Zellen. Kv10.1 wird erst hergestellt, nachdem E2F1 aktiviert wurde. E2F1 ist normalerweise an das Protein Retinoblastom (Rb) gebunden, das dafür sorgt, dass der Transkriptionsfaktor inaktiv ist. Zusätzlich halten weitere Faktoren wie miRNAs (miR34a) oder das Tumor-Supressor-Protein p53 den Faktor E2F1 inaktiv und unterdrücken somit auch die Expression von Kv10.1. Andererseits verursachen einige krebserregende Faktoren, wie z. B. das humane Papillomavirus, durch die Aktivierung von E2F1 eine vermehrte Expression von Kv10.1.
Interessanterweise zeigt ein großer Teil von Tumoren Veränderungen in den Genen von E2F1, Rb und/oder p53. Diese Tatsache erklärt, zusammen mit der verstärkten Proliferation und damit erhöhten Menge an Zellen in der G2-/M-Phase, warum Kv10.1 in mehr als zwei von drei Tumoren zu finden ist. Dennoch vermehren sich Zellen, die Kv10.1 exprimieren, schneller als Kv10.1-negative Zellen. Deshalb ist es möglich, Tumorwachstum durch eine Hemmung des Kaliumkanals zu reduzieren. Kv10.1 ist der einzig bekannte Ionenkanal mit dieser Eigenschaft; daher sollte der Grund dafür für Kv10.1 spezifisch sein. Bei fast allen ruhenden Zellen in der G0-Phase ragt eine einzelne, haarförmige Struktur in die Umgebung, die als chemischer und mechanischer Detektor wirkt (Abb. 2). Diese Organelle, das primäre Cilium, erfüllt viele wichtige Funktionen während der Entwicklung. Es kommt nur in der G0-Phase vor, weil es zurückgezogen und demontiert werden muss, sobald die Zellteilung startet.
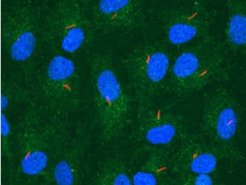
Primäre Cilien sind aus Mikrotubuli aufgebaute Strukturen, die durch eine spezialisierte Membran an ihrer Basis zusammengehalten werden. Diese komplexe Struktur des Basalkörpers wird vorwiegend aus der Mutterzentriole gebildet und von Zelle zu Zelle weitergegeben. Im Prozess der Zellteilung entsteht nach Einzug des Ciliums aus der Mutterzentriole, zusammen mit einem kleineren, als Tochterzentriole bezeichneten Baustein, ein Centrosom, welches zum Polkörper wird. Dieses Centrosom wird ebenfalls unter kontrollierten Steuerungsmechanismen verdoppelt, um zusammen den für die Chromosomentrennung notwendigen Spindelapparat zu bilden. Nach der Teilung der Zellen wird aus der Mutterzentriole wieder ein Basalkörper für das Primärcilium aufgebaut. Die Funktionen dieser komplexen Struktur variieren, je nachdem, wo sich diese befindet.
Überexpression von Kv10.1 löst die Bremse der Zellteilung
Kv10.1 ist in vielen Zellen im Primärcilium exprimiert. Wird in Zellkulturen der Kv10.1 unterdrückt, ist die G0-Phase und die Präsenz der Primärcilia verlängert, während eine Überexpression diese so verkürzt, dass die Zellen keine Primärcilia besitzen und sich fortlaufend teilen [2]. Dies ist ein Vorteil in Bezug auf die Vermehrungsrate, den Kv10.1-exprimierende Zellen haben. Eine erniedrigte Expression hat nur sehr geringe Konsequenzen für den Organismus, im Gegensatz dazu führt jedoch die erhöhte Expression zu Auswirkungen, die sowohl neuronal als auch entwicklungsphysiologisch auf die Funktion des Kanals im Gehirn [3] und auf seine Rolle in der Kontrolle des primären Ciliums zurückzuführen sind. Kv10.1 wird im Gehirn exprimiert, jedoch befinden sich diese Zellen in G0. Wie sich jedoch zeigte, ist eine übernormale Expression von Kv10.1 in Gehirntumoren von Patienten mit einer schlechteren Prognose gekoppelt [4].
Zusammenfassend kann man sagen, dass durch Veränderungen zahlreicher Faktoren, wie z. B. p53, die Expression von Kv10.1 manchmal ausgelöst wird, obwohl der Kanal nicht exprimiert werden sollte. Dies führt dazu, dass durch die Überexpression von Kv10.1 das primäre Cilium, die „Bremse der Zellteilung“, sozusagen gelöst wird und die Zellteilung und das Gewebewachstum begünstigt werden. Auf diese Weise teilen sich die Zellen, die viel Kv10.1 exprimieren, schneller. Diese Zellpopulation wird nach kurzer Zeit den größten Teil des Tumors bilden. Schließlich wird sich ein Tumor gebildet haben, in dem die Mehrzahl der Zellen kontinuierlich Kv10.1 exprimiert.
Noch sind nicht alle Aspekte der Rolle dieses Kaliumkanals aufgeklärt, aber es ist ausreichend abgesichert, dass er eine wichtige Rolle im Krebsgeschehen spielt [5]. Die leichte Nachweisbarkeit des Kv10.1 durch seine extrazelluläre Zugänglichkeit für fluoreszierende Antikörper [6] und seine Präsenz in vielen Tumorarten erlauben die Verwendung dieses Proteins für diagnostische Zwecke. Zudem stellt dies einen weiteren Angriffspunkt für neue Medikamente gegen Krebs dar.

