Forschungsbericht 2016 - Max-Planck-Institut für Infektionsbiologie
Die Jungbrunnen des Immunsystems
Stammzellen-Reparatur mittels CRISPR-Cas9
Biologen sind von der lebenslangen Fähigkeit der hämatopoietischen Stammzellen und ihrer Flexibilität fasziniert, die es ihnen erlaubt, ein Leben lang als einzelne Zellen entweder in völliger Ruhe in speziellen, Energie-sparenden Nischen des Knochenmarks zu verharren, oder aktiv zu werden, im Blut durch den ganzen Körper zu wandern, und wieder ins Knochenmark zurückzufinden. Bei der Maus, und sicher auch beim Menschen, reicht eine einzige Zelle, um nach Transplantation in einen lethal bestrahlten, chemotherapeutisch behandelten Rezipienten alle tausend Milliarden roter und weißer Blutzellen einer Maus, und tausend mal mehr Zellen des Menschen zu regenerieren.
Das wiederum begeistert die Kliniker, die hoffen, ein defektes Gen, das zu Immundefizienz führt, mit Hilfe von Gentherapie in hämatopoietischen Stammzellen reparieren zu können. Dabei sind sie darauf angewiesen, dass diese Stammzellen nach der Reparatur immer noch alle Eigenschaften haben, mit denen sie ihre Nischen im Knochenmark langzeitig wieder füllen, mit denen sie aktiv werden, wandern können und alle Typen von Blutzellen bilden - in unveränderter Zahl und Qualität. Sie sind fasziniert von der traumwandlerischen Sicherheit der Stammzellen, nach intravenöser Transplantation ihren Weg durch die Wände der Blutbahnen in die Nischen des Knochenmarks zu finden, in denen sie wieder ein Leben lang die Blutzellproduktion übernehmen.
Am saubersten wäre es, diese Transplantationen mit einer einzigen Stammzelle, ohne mögliche Verunreinigung durch andere, möglicherweise immun-auto-aggressive, oder nicht präzise Gen-reparierter Zellen durchführen zu können. Die neue CRISPR-Cas9 Gen-Reparaturmethode verspricht, den Ersatz eines defekten Gens durch ein normal funktionierendes ohne die bisher so gravierenden Fehler zu bewerkstelligen, die der virale Einbau solcher Gene durch unerwünschte, krebserregende Insertions-Mutagenese bisher zu gefährlich gemacht hat, hämatopoietischen Defizienzen in hämatopoietischen Stammzellen zu heilen. Aber selbst wenn der Einbau des reparierenden Gens präzise ist, bleibt noch viel zu tun, die hämatopoietischen Stammzellen rezeptiv für den Gen-Einbau zu machen. Da der Einbau in Gewebekultur außerhalb der normalen Nischenumgebung im Knochenmark gemacht werden muss, sind – auch unsere – noch nicht befriedigenden Anstrengungen wichtig, die Stammzellen „bei Laune“ zu halten, sodass sie ihre vielen Fähigkeiten nicht verlieren, nach Genkorrektur und Transplantation im Rezipienten ein stabiles, langzeitig funktionierendes Blut- und Immunsystem zu restorieren.
Auch Onkologen, die Krebspatienten mit Bestrahlung und Chemotherapie von Krebszellen befreien wollen, danach aber all die ebenfalls zerstörten normalen Zellen des Bluts und des Immunsystem eines Patienten mit einer „Knochenmarks-Transplantation“ retten müssen, würden wohl am liebsten nur eine einzige, gesunde Stammzelle, frei von verunreinigenden Krebszellen transplantieren.
Wir hatten es uns also zum Ziel gesetzt, zu verstehen, wie eine Stammzell-Nische im Knochenmark gebildet wird, wie sie funktioniert, und ob wir sie in Gewebekultur nachbauen können.
Können wir hämatopoietische Stammzellen in Gewebekultur aus toti-potenten embryonalen Stammzellen (ES-Zellen) oder aus induzierten pluripotenten Stammzellen (iPS-Zellen) entwickeln?
Vor der neuerlichen Entdeckung und Entwicklung der CRISPR-Cas9 homologen Geninsertionsmethode waren ES-Zellen die einzigen, in denen der Einbau eines Gens in das Erbgut der Zelle an der richtigen Stelle, also mittels homologer Rekombination möglich war. Wenn es uns also gelungen wäre, aus ES-Zellen hämatopoietische Stammzellen zu entwickeln, wären wir in der Lage gewesen, die Funktion und mögliche Reparatur von wichtigen Genen zu untersuchen. Unsere mehrjährigen Versuche [1] sind aber, wie auch die mehrerer anderer Arbeitsgruppen, erfolglos geblieben.
Weil diese Gewebekulturen wohl reife Zellen des Blut-und Immunsystems entwickelten, sie aber zu keiner Zeit dieser Entwicklung transplantierbare Stammzellen bildeten, hatten wir den Verdacht, dass sie vielleicht in einer Endothel- und Nischen-losen Gewebekulturumgebung nicht gelernt hätten, normal zu wandern und zu residieren.
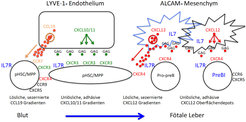
Wie also bewerkstelligen es hämatopoietische Stammzellen und Progenitoren, vom Blut durch die Blutwand auf die Innenseite von fötaler Leber und in das Knochenmark zu gelangen?
Stammzellen bilden auf ihrer Oberfläche eine Vielzahl verschiedener Rezeptoren für Chemokine aus, die sie in die Lage versetzen, auf Erkennung eines solchen Chemokins hin chemotaktisch angezogen zu wandern. Welche Rezeptoren sie dabei benutzen, welche Chemokine das vaskuläre Endothel der Blutwand und das mesenchymale Stroma bereitstellen, damit sie mit ihren Zytokin-Rezeptoren die vom Mesenchym bereitgestellten Zytokine, zum Beispiel IL7, erkennen und zu lymphoider Differenzierung stimuliert werden, ist in [2] im Detail beschrieben und in Abbildung 1 dargestellt.
Sind die hämatopoietischen Stammzellen und die sich daraus differenzierenden Vorläufer-B-Lymphozyten am Mesenchym der fötalen Leber angelangt, dann beginnen sie, Immunglobulin (Ig) Gene zu rearrangieren und danach IgM-Antikörper auf ihrer Oberfläche zu deponieren – je Zelle immer einen einzigartigen Antigenrezeptor. Es ist gelungen, durch Transformation mit Onkogenen die verschiedenen Stufen dieser Zellentwicklung nachzustellen und in einzelnen Stufen zu fixieren [3]. Damit wurden jetzt Instrumente geschaffen, die erlauben, die Repertoireentwicklung dieser ersten B1-Welle der Antikörper-produzierenden B-Zellen unseres Immunsystems zu vermessen und ihre maligne Transformation zu B-Zell Lymphome zu verfolgen.
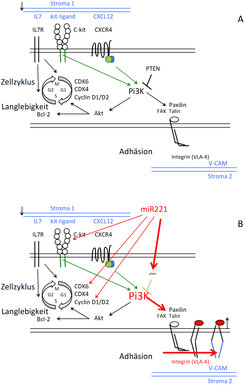
Sind die Stammzellen und Vorläuferzellen einmal in ihren Nischen im Knochenmark angekommen, wie schaffen sie es dann, sesshaft zu werden?
Die Aktivitäten einer Micro-RNA hat uns geholfen, zu entdecken, dass Adhäsion an Zellen in den Nischen eine Residenz ermöglicht. Alle hämatopoietischen Zellen des Knochenmarks, die nach Transplantation in das Knochenmark zurückwandern und dort wieder sesshaft werden können, bilden miR221. Experimentell induzierte Re-expression dieser miR221 in PräB-Zellen, die nach Transplantation normalerweise im Knochenmark nicht mehr sesshaft werden können, bewirkt, dass diese Zellen die Fähigkeit wiedergewinnen, ihre Residenz in subostealen Nischen zu beziehen. In Gewebekultur erlangen diese Zellen die Fähigkeit, an einem Adhäsionsmolekül, VCAM, zu haften. Sie können das, weil miR221 gezielt die Messenger RNA von PTEN abbaut. PTEN inhibiert einen Signaltransduktionsweg der Zelle, bei dem Pi3-Kinase, Akt, Paxilin, Talin und fokale Adhäsionskinase (FAK) das Adhäsionsmolekül Integrin VLA4 aktiviert. Wenn PTEN abnimmt, wird Pi3Kinase Aktivität erhöht und damit auch die komplette Signaltransduktionskette stärker aktiviert, sodass am Ende der Kette die Integrinmoleküle ihre Konformation ändern mit der Folge, dass sie VCAM1 viel besser binden können (Abb. 2; [4]). Wir vermuten, dass alle hämatopoietischen Zellen mit der Fähigkeit, in Nischen des Knochenmarks sesshaft zu werden, diesen miR221-regulierten molekularen Mechanismus der Adhäsion durch Integrine für ihre Residenz benutzen.
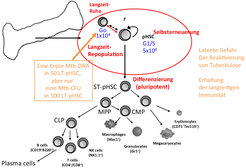
Können ruhende hämatopoietische Stammzellen Ruhe für symbiotische Bakterien bieten?
Nischen der hämatopoietischen Stammzellen finden sich nahe vaskulärem Endothel der Blutgefäße, durch das sie vom Blut in das Innere des Knochenmarks gewandert sind. Ein Teil von ihnen teilt sich regelmäßig, vielleicht einmal am Tag und asymmetrisch. Eine der Tochterzellen bleibt eine Stammzelle, erneuert sich also in diesem Teilungsprozess, während sich die andere auf die Wege der Differenzierung macht, bei denen am Ende reife Zellen des Blut- und Immunsystems gebildet werden. Ein anderer Teil der Stammzellen verharrt in einem Zustand der metabolischen Ruhe, in dem sich die Zellen fast nie, nur vielleicht zweimal im Jahr teilen und Energie-sparende molekulare Programme nutzen, um lange zu überleben. So haben sie die oxidative Phosphorylierung in Mitochondrien reduziert, auch, weil sie viele dieser Mitochondrien durch Autophagie abgebaut haben. Sie produzieren das wenige ATP, das sie zum Überleben brauchen, durch Lipolyse und Glycolyse. Viele dieser Stammzellen haben Hypoxie Gene aktiviert, was darauf schließen lässt, dass sie in Gegenden des Knochenmarks residieren, die eine niedere Sauerstoffzufuhr haben. Diese ruhenden Zellen besitzen die beste Langzeit-Repopulationskraft bei Transplantationen. Unsere Analysen haben sie in einem Reservoir von nicht mehr als 10 000 Langzeit-ruhenden Zellen des Knochenmarks einer Maus gefunden.
Wäre es möglich, dass Bakterien, die innerhalb von hämatopoietischen Zellen existieren können, also „fakultativ intrazellulär“ sind, diese Inseln der Ruhe, also die Nischen der langlebigen Stammzellen, dazu nutzen, selbst langlebig und ruhend zu werden? Könnten diese Stammzellen zu Depots von latenten Infekten werden? Stammzellen könnten ja aus dem Knochenmark durch das Blut an Stellen einer Infektion wandern, infiziert werden, und danach in die Ruhe der Nischen des Knochenmarks zurückkehren.
Ein solches fakultativ intrazelluläres Bakterium ist Mycobacterium tuberculosis (M.tb), der Erreger der Tuberkulose. Es wird geschätzt, dass ein Drittel der Weltbevölkerung, also 2,5 Milliarden Menschen, latent mit M.tb. infiziert ist, ohne dass es zum Ausbruch von Tuberkulose kommt. „Nur“ 10 Millionen Menschen sterben jährlich an Tuberkulose - ein Zeichen effektiver Immunität? Das Immunsystem ist in diesen Menschen durch die Infektion zu einer Abwehr aktiviert worden, die durch M.tb.-spezifische Immunreaktionen nachweisbar ist (Abb. 3).
Trotz unseres Verdachts war es sehr überraschend, dass selektiv etwa 1 % der langlebigen hämatopoietischen Stammzellen, und nur sie, in latent M.tb. infizierten Mäusen und Menschen das Bakterium trugen [5]. Diese M.tb. Bakterien scheinen sich, wie ihre Gastzellen, in einem Ruhezustand zu befinden, in dem sie sich nicht teilen und in dem sie Gene benutzen, die bei Dormanz aktiviert sind. Diese dormanten Bakterien können also eine Quelle möglicher Wiederbelebung von akut infizierenden M.tb. sein, die so zu lebensgefährlicher Tuberkulose führen kann. Andererseits können die infizierten Stammzellen auch kontinuierliche Quellen der Produktion von M.tb. Antigenen, also einer M.tb. Vakzine sein, die die Immunität gegen die möglicherweise lebensbedrohende Infektion aufrechterhält.
Danksagung
Der Autor dankt der Biologisch-Medizinischen Sektion der Max-Planck-Gesellschaft, dem Max-Planck-Institut für Infektionsbiologie und dem Präsidium der Max Planck Gesellschaft, für mehr als zwölf Jahre einer noch nie dagewesenen Forschungsunterstützung nach seiner Pensionierung als wissenschaftliches Mitglied des Basler Instituts für Immunologie. Er wurde von 2009 bis 2014 von der Deutschen Forschungsgemeinschaft im Rahmen ihres Koselleck Programms und von der Humboldt-Stiftung mit zwei Humboldt Stipendiaten gefördert.


